题目内容
4.a g铜与含b g HNO3的硝酸溶液恰好完全反应,若a:b=8:21,则反应中起氧化作用的HNO3的质量是( )| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
分析 根据a:b=8:21,则物质的量之比为$\frac{8}{64}$:$\frac{21}{63}$=3:8,刚好符合铜和稀硝酸反应的物质的量之比,根据起酸性作用的HNO3生成硝酸铜,剩余的硝酸表现氧化性,则8mol硝酸反应,只有$\frac{1}{4}$在反应中起氧化作用.
解答 解:根据a:b=8:21,则物质的量之比为$\frac{8}{64}$:$\frac{21}{63}$=3:8,刚好符合铜和稀硝酸反应的物质的量之比,8mol硝酸反应,只有$\frac{1}{4}$在反应中起氧化作用,起氧化作用HNO3的质量是全部硝酸质量的0.25倍,所以反应中起氧化作用的HNO3的质量是0.25b,
故选D.
点评 本题考查了物质的量的有关计算,题目难度不大,注意硝酸的性质,起酸性作用的HNO3生成硝酸铜.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
14.常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示.下列说法不正确的是( )
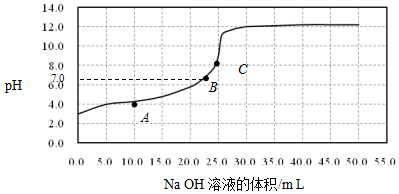

| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
15.兵马俑中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法错误的是( )
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |
12.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1 mol/L CaCl2溶液中含有Cl-的数目为NA | |
| B. | 标准状况下,2.24L HF所含分子数一定为0.1NA | |
| C. | 6.4g S6与S8的混合物中所含S原子数一定为0.2NA | |
| D. | 标准状况下,2.24L 氧元素的单质所含原子数一定为0.2NA |
19.下列说法正确的是( )
| A. | 由原子构成的晶体不一定是原子晶体 | |
| B. | 分子晶体中的分子间可能含有共价键 | |
| C. | 分子晶体中一定有共价键 | |
| D. | 分子晶体中分子一定紧密堆积 |
4.CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如表:
(1)开展实验1和实验2的目的是研究温度对该化学平衡的影响.
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)已知CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,求算:△H2=-1160kJ/mol.
| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)已知CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,求算:△H2=-1160kJ/mol.
11.由于少数不法商贩惟利是图,假酒、假盐、假药等引起的中毒事件屡有发生.下列物质被误食后,不会引起中毒的是( )
| A. | NaNO2 | B. | AgNO3 | C. | BaCO3 | D. | BaSO4 |
9.下列说法正确的是( )
| A. | 光化学烟雾的主要原因与排放SO2有关 | |
| B. | 工业上用二氧化硫来漂白纸浆、毛、丝、草帽、食品等 | |
| C. | 闪电时,大气中常伴有少量的NO2产生 | |
| D. | 正常雨水的PH小于5.6 |