题目内容
18.下列有关气体摩尔体积的描述中正确的是( )| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |
分析 A.气体摩尔体积和温度压强有关,是一定温度压强下单位物质的量的气体体积;
B.标准状况下气体摩尔体积是指1mol任何气体所占的体积约为22.4L;
C.标准状况下气体摩尔体积是指1mol任何气体所占的体积约为22.4L;
D.气体摩尔体积是温度压强一定条件下的物理量.
解答 解:A.气体摩尔体积只与气体的存在条件有关,与物质的量无关,温度压强相同,气体的摩尔体积相同,故A错误;
B.气体摩尔体积是指一定温度压强下,1mol任何气体所占的体积,不同条件下,气体摩尔体积的数值不同,标准状况下约为22.4L/mol,故B错误;
C.标准状况下气体摩尔体积是指1mol任何气体所占的体积约为22.4L,即气体摩尔体积约为22.4L/mol,故C正确;
D.气体摩尔体积是温度压强一定条件下的物理量,温度压强不知,不能判断气体摩尔体积,故D错误;
故选C.
点评 本题考查了气体摩尔体积概念的分析应用,应用条件和概念实质是解题关键,题目较简单.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3COO-、Fe2+ | |
| B. | 水电离的OH-浓度为10-12mol/L-1的溶液中:Mg2+、NH4+、AlO2-、SO32- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4-、Cl- |
9.全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O$?_{放电}^{充电}$ VO2++2H++V2+.下列叙述正确的是( )
| A. | 放电过程中电解质溶液中阴离子移向正极 | |
| B. | 放电时每转移0.5mol电子,负极有0.5molV2+被氧化 | |
| C. | 充电时阳极附近溶液的酸性减弱 | |
| D. | 充电时阳极反应式为:VO2++2H++e-═VO2++H2O |
6.欲除去铁粉中少量的铝粉,可选用的试剂是( )
| A. | 水 | B. | 氢氧化钠溶液 | C. | 稀硫酸 | D. | 稀硝酸 |
3.下列说法正确的是( )
| A. | 用广泛pH试纸测得氯水的pH=5.2 | |
| B. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| C. | 在氧化还原反应中,还原剂得到电子总数等于氧化剂失去电子的总数 | |
| D. | Mg在CO2中燃烧生成MgO和C.在该反应条件下,Mg的还原性强于C的 |
10.下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀
③钠在常温下不容易被氧化,加热下被氧化成白色固体
④Na2O2可作供氧剂,而Na2O不行
⑤Na2CO3溶液和NaHCO3溶液都呈碱性.
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀
③钠在常温下不容易被氧化,加热下被氧化成白色固体
④Na2O2可作供氧剂,而Na2O不行
⑤Na2CO3溶液和NaHCO3溶液都呈碱性.
| A. | 都正确 | B. | ②③④⑤ | C. | ②③⑤ | D. | ②④⑤ |
7.钠长时间放在空气中,最后的产物主要成分是( )
| A. | Na2O | B. | NaOH | C. | Na2CO3 | D. | Na2CO3•10H2O |
8. 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.
(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
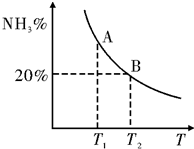
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
①则该反应△H>0,表中数据a<d,b<f(均选填“>”、“=”或“<”).
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.