题目内容
镁、铝和铜的混合物中依次加入过量盐酸、过量烧碱溶液并充分反应后,原混合物中金属的最终存在形式正确的是( )
| A、Mg2+ |
| B、Al3+ |
| C、AlO2- |
| D、Cu(OH)2 |
考点:镁的化学性质,铝的化学性质,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:在金属活动顺序表中,排在氢前面的金属能和非强氧化性的酸反应生成氢气,金属镁和铝能溶于盐酸,铜和盐酸不反应,过滤后向滤液中加入过量烧碱溶液,镁离子能和烧碱反应转化为氢氧化镁沉淀,铝离子和过量的烧碱反应生成偏铝酸盐,据此分析解答.
解答:
解:在金属活动顺序表中,排在氢前面的金属能和非强氧化性的酸反应生成氢气,镁、铝、铜三种金属粉末混合物,加入过量盐酸,金属镁和铝能溶于盐酸,发生的离子反应有:Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+,过滤,滤液为氯化镁、氯化铝、盐酸,滤渣为铜,过滤后向滤液中加入过量烧碱溶液,过量的氢离子和氢氧根离子结合生成水,镁离子成为氢氧化镁沉淀,铝离子变成偏铝酸根离子,发生的离子反应有:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+H2O,所以再过滤,滤液中存在的离子有AlO2-,
故选C.
故选C.
点评:本题以元素的存在方式为载体考查了金属镁铝铜的性质,明确发生的反应是解本题关键,题目难度不大.

练习册系列答案
相关题目
室温下,0.1mol/L的HA溶液中
=1010.下列有关说法正确的是( )
| c(H+) |
| c(OH-) |
| A、溶液的pH=4 | ||
B、加蒸馏水稀释后,
| ||
| C、体积和pH均相等的HA与盐酸中加入足量锌,盐酸中产生的气体多 | ||
| D、在NaA溶液中存在浓度关系:c(H+)>c(OH-) |
下列离子方程式书写正确的是( )
A、酸性高锰酸钾与少量双氧水反应:2MnO
| ||||
B、用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
C、Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO
| ||||
| D、向NaClO溶液中通入过量CO2;CO2+ClO-+H2O=HCO3-+HClO |
下列有关实验的叙述正确的是( )
| A、检验溶液中SO42-的方法是:先加入BaCl2溶液,再加盐酸 |
| B、从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 |
| C、证明气体分子中含有“C=C”的方法是:将该气体通入KMnO4酸性溶液 |
| D、除去CO2中少量HCl的方法是:将混合气体通过盛有饱和NaHSO3溶液的洗气瓶 |
已知某元素+2价离子的电子排布式为1s22s22p63s23p6,该元素在周期表中位置是( )
| A、第三周期零族元素 |
| B、第四周期ⅡB族 |
| C、第四周期Ⅷ族 |
| D、第四周期ⅡA族 |
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A、AgNO3 |
| B、FeSO4 |
| C、MgCl2 |
| D、(NH4)2SO3 |
常温下,下列各组离子在指定的溶液中一定能大量共存的是( )
| A、使酚酞变红的溶液:Na+、Cu2+、Cl-、HCO3- |
| B、使石蕊变红的溶液:K+、Fe3+、NO3-、I- |
| C、0.1mol/L的NaCl溶液.Al3+、NH4+、SO42-、NO3- |
| D、pH=1的硫酸溶液:Ba2+、K+、OH-、CH3COO- |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol甲烷中含有10NA个质子 |
| B、27g铝被完全氧化成氧化铝,失去2NA个电子 |
| C、标准状况下,22.4 L苯含有NA个C6H6分子 |
| D、常温常压下,28g乙烯含有2NA个碳碳双键 |
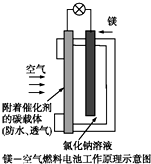 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |