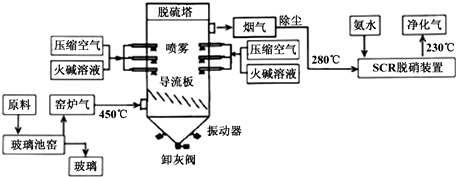
题目内容
6.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )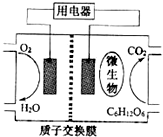
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
分析 A.从蛋白质的性质:高温下会变性分析;
C.原电池负极发生失电子的氧化反应,据此书写电极反应;
B.原电池内部阳离子向正极移动;
D.根据正负极电极反应式结合电子守恒进行计算.
解答 解:A.高温条件下微生物会变性,该电池不能够在高温下工作,故A错误;
B.负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C、原电池内部阳离子应向正极移动,则放电过程中,质子(H+)从负极区向正极区迁移,故C正确;
D、正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D正确;
故选A.
点评 本题考查了原电池原理、电极方程式的书写、离子的移动方向,有关化学方程式的计算,有关气体体积的计算要注意温度和压强,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列说法不正确的是( )
| A. | 为减少环境污染,常使用乙醇汽油代替化石燃料,乙醇可通过纤维素转化制得,是一种可再生的燃料 | |
| B. | 优良的催化剂可以降低反应温度,起到节能效果并提高反应物的转化率 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂载体等 |
14.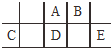 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
18.如图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( )


| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
15.关于电化学内容,下列说法正确的是( )
| A. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
16.下列八种物质:①丙烯、②甲苯、③聚氯乙烯、④聚异戊二烯、⑤丙炔、⑥环己烷、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |