题目内容
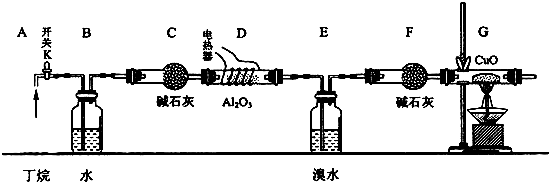
3.A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.
(1)写出物质B的电子式
 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族(填写哪个周期和哪个族),写出物质B与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)写出下列反应的化学反应方程式:
⑤3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
⑧4Fe(OH)2+O2+2H2O═4 Fe(OH)3
(3)写出反应的离子方程式:⑦Fe3O4+8H+=Fe2++2Fe3++4H2O
(4)在①-⑧的所有反应中,属于非氧化还原反应的有(填序号)⑦
(5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水.
分析 H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ,则H为Fe(OH)2,I为Fe(OH)3,C为红棕色粉末,则C为Fe2O3,D为Fe,F为FeCl3,E为黑色晶体,则E为Fe3O4,反应⑦为Fe3O4与盐酸反应,则G为FeCl2,银白色金属单质A转化得到B为淡黄色粉末,则A为Na,B为Na2O2,据此解答.
解答 解:H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ,则H为Fe(OH)2,I为Fe(OH)3,C为红棕色粉末,则C为Fe2O3,D为Fe,F为FeCl3,E为黑色晶体,则E为Fe3O4,反应⑦为Fe3O4与盐酸反应,则G为FeCl2,银白色金属单质A转化得到B为淡黄色粉末,则A为Na,B为Na2O2.
(1)物质B为Na2O2,电子式为 ,D为Fe元素,在元素周期表中的位置为:第四周期第Ⅷ族,物质B与水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,
,D为Fe元素,在元素周期表中的位置为:第四周期第Ⅷ族,物质B与水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,
故答案为: ;第四周期第Ⅷ族; 2Na2O2+2H2O=4NaOH+O2↑;
;第四周期第Ⅷ族; 2Na2O2+2H2O=4NaOH+O2↑;
(2)反应⑤的化学反应方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
反应⑧的化学反应方程式:4Fe(OH)2+O2+2H2O═4 Fe(OH)3,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;4Fe(OH)2+O2+2H2O═4 Fe(OH)3;
(3)反应⑦的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)在①-⑧的所有反应中,反应⑦为Fe3O4与盐酸反应,属于非氧化还原反应,其它均为氧化还原反应,
故答案为:⑦;
(5)Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水,
故答案为:Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水.
点评 本题考查无机物推断,主要涉及Fe元素单质化合物性质,物质的颜色是推断突破口,熟练掌握元素化合物性质,难度中等.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案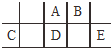 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |

| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:乙烯(写一种).
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验.
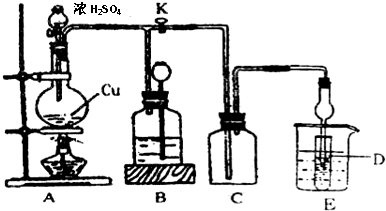
①装置B的作用是贮存多余的气体.B中应放置的液体是d(填序号).
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.Fe粉b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+2H2SO4+O2=2CuSO4+2H2O.
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)=2 c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(3)利用FeCl3溶液的氧化性也可以吸收SO2.
①该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.检验FeCl3是否完全被还原的方法为取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05mol•L-1 FeCl3溶液中,溶液很快由黄色变为红褐色; 将溶液长时间放置后,最终变为浅绿色. 关于红褐色液体,以下是同学们的分析推测及实验.
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH) 3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2?Fe(SO2)63+ (反应b) | ⅰ.制备Fe(OH) 3胶体并检验 ⅱ.分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
根据反应b,说明步骤ⅱ中液体颜色变化的原因是加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应Fe3++6SO2?Fe(SO2)63+ 逆向移动(用离子方程式结合必要的文字说明).
| A. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| A. | 冰的密度小于液态水 | B. | 氨气易液化 | ||
| C. | HF的沸点高于HI | D. | 有机物普遍存在同分异构现象 |
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
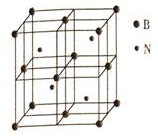 氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,
氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,