题目内容
19.合成氨反应N2+3H2$?_{△}^{Fe}$2NH3,其化学反应速率可以用v(H2)、v(N2)、v(NH3)来表示,单位[mol/(L•s)],那么正确的关系式是( )| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=1.5v(H2) | D. | v(N2)=2v(H2) |
分析 反应速率之比等于化学计量数之比,以此来解答.
解答 解:A.化学计量数之比为1:3:2,则反应速率不相等,故A错误;
B.氢气与氮气的化学计量数之比为3:1,则v(H2)=3v(N2),故B正确;
C.氨气与氢气的化学计量数之比为2:3,则1.5v(NH3)=v(H2),故C错误;
D.氮气与氢气的化学计量数之比为1:3,则v(H2)=3v(N2),故D错误;
故选B.
点评 本题考查化学计量数与反应速率的关系,为高频考点,把握反应速率之比等于化学计量数的之比为解答的关键,侧重分析与应用能力的考查,注意判断化学计量数关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列关于电池的说法正确的是( )
| A. | 原电池负极金属一定比正极金属的金属性活泼 | |
| B. | 原电池中电解质溶液中的阳离子向负极移动 | |
| C. | 碱性锌猛锰干电池的负极反应为:Zn-2e-+4OH-=ZnO22-+2H2O | |
| D. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g |
7.用下列实验装置进行相应实验,能达到实验目的是( )
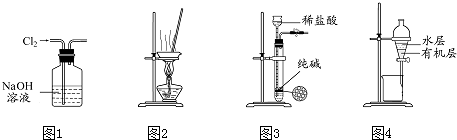

| A. | 用图1 所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2 所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体 | |
| C. | 用图3 所示装置制取少量纯净的CO2气体 | |
| D. | 用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
14.已知Cu(NO3)2受热分解的化学反应方程式为2Cu(NO3)2=2CuO+4NO2↑+O2↑,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是( )
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 木条复燃是因为硝酸铜分解产生了CuO催化作用的结果 |
4.有6克含杂质的Na2SO3与足量盐酸反应,得气体1.12升(STP),且该气体的平均相对分组质量为60,则杂质可能是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3和NaHCO3 | D. | Na2SO4 |
11.Wg10%的盐酸要使其浓度增大一倍,可采用的方法是( )
| A. | 再通入$\frac{W}{10}$g氯化氢 | B. | B、蒸发浓缩成$\frac{W}{2}$g | ||
| C. | 蒸发掉溶剂的一半 | D. | 再加入2Wg25%盐酸 |
8.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )
| W | X | Y |
| Z |
| A. | Z、X、Y形成的气态氢化物稳定性依次增强 | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素的原子半径:rZ>rY>rX>rW | |
| D. | 四种元素中,X的氧化物对应的水化物酸性最强 |

 .
.