��Ŀ����
2��V��W��X��Y��Z����Ԫ�أ����ǵĺ˵�������������Ҷ�С��20�����У�X��Z�ǽ���Ԫ�أ�V��ZԪ��ԭ�ӵ�����㶼ֻ��һ�����ӣ���VΪ�ǽ���Ԫ�أ�W��YԪ��ԭ�ӵ�������������ͬ����WԪ��ԭ��L���������K���������3����XԪ��ԭ�ӵ�������������YԪ��ԭ��������������һ�룮�ɴ���֪����1��V��H��X��Al��Z��K����Ԫ�ط��ţ���
��2��Y��Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壮
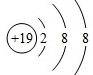
��3��д��Z���ӵĽṹʾ��ͼ
 ��
����4��W��Y����Ԫ�غ�����ɵ���̬�⻯��ѧʽ�����ȶ�����õ���H2O����ԭ����ǿ����H2S��
��5������Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ��K��Al��S��O��H��
��6��X��Z�Ľ�������ǿ������˳��ΪK��Al����Ԫ�ط��ű�ʾ��������˵����ǿ����ϵ����ʵ�ǣ���дһ�����ɣ�KOH�ļ��Ա�Al��OH��3ǿ��
���� V��W��X��Y��Z����Ԫ�أ����ǵĺ˵�������������Ҷ�С��20��V��ZԪ��ԭ�ӵ��������Ӷ�ֻ��һ����ZΪ������VΪH��ZΪNa��K��WԪ��ԭ��L���������K���������3������WΪOԪ�أ�W��YԪ��ԭ�ӵ�������������ͬ����YΪS��XԪ��ԭ�ӵ�������������YԪ��ԭ��������������һ�룬��XΪB��Al����X�ǽ���Ԫ�أ���Xֻ��ΪAl������V��W��X��Y��Z�˵������������ZΪK���Դ�������⣮
��� �⣺V��W��X��Y��Z����Ԫ�أ����ǵĺ˵�������������Ҷ�С��20��V��ZԪ��ԭ�ӵ��������Ӷ�ֻ��һ����ZΪ������VΪH��ZΪNa��K��WԪ��ԭ��L���������K���������3������WΪOԪ�أ�W��YԪ��ԭ�ӵ�������������ͬ����YΪS��XԪ��ԭ�ӵ�������������YԪ��ԭ��������������һ�룬��XΪB��Al����X�ǽ���Ԫ�أ���Xֻ��ΪAl������V��W��X��Y��Z�˵������������ZΪK��
��1�����ݷ�����֪��VΪH��XΪAl��ZΪK��
�ʴ�Ϊ��H�� Al�� K��
��2��YΪSԪ�أ�ԭ������Ϊ16��λ�����ڱ��е������ڵڢ�A�壬
�ʴ�Ϊ���������ڵڢ�A�壻
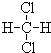
��3��Z������ΪK+�������ӵĺ˵����Ϊ19�������������Ϊ18�����������8�����ȶ��ṹ�������ӽṹʾ��ͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
��4��WΪO��YΪSԪ�أ��ǽ�����Խǿ����̬�⻯����ȶ���Խǿ�����⻯���ȶ��Խ�ǿ��ΪH2O���ǽ�����Խǿ����Ӧ�⻯��Ļ�ԭ��Խ������ԭ�Խ�ǿ��ΪH2S��
�ʴ�Ϊ��H2O��H2S��
��5�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ���Ӳ���ͬʱ���˵����Խ��ԭ�Ӱ뾶ԽС��������ԭ�ӵ�ԭ�Ӱ뾶��СΪ��K��Al��S��O��H��
�ʴ�Ϊ��K��Al��S��O��H��
��6��XΪAl��ZΪK��K�Ľ����Խ�ǿ����������K��Al������������Ӧˮ����ļ���Խǿ�����Ӧ�����Ľ�����Խǿ���ɸ���KOH�ļ��Ա�Al��OH��3ǿ�ó�������K��Al��
�ʴ�Ϊ��K��Al��KOH�ļ��Ա�Al��OH��3ǿ��
���� ���⿼����λ�á��ṹ�����ʹ�ϵ��Ӧ�ã���Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ���ע������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ��������ؿ���ѧ���ķ���������������������

| A�� | v��H2��=v��N2��=v��NH3�� | B�� | v��H2��=3v��N2�� | C�� | v��NH3��=1.5v��H2�� | D�� | v��N2��=2v��H2�� |
| A�� | H2SO4��aq��+Ba ��OH��2��aq���TBaSO4��s��+2H2O��l����H=-114.6 kJ•mol-1 | |
| B�� | 2KOH��aq��+H2SO4��aq���TK2SO4��aq��+2H2O��l����H=-57.3 kJ•mol-1 | |
| C�� | C ��s��ʯī��+O2��g���TCO2��g����H=-393.5kJ•mol-1 | |
| D�� | C ��s��ʯī��+$\frac{1}{2}$O2��g���TCO ��g����H=-393.5kJ•mol-1 |

 ��
�� 
 ��
��