题目内容
4.对下列现象或事实的解释正确的是( )| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应会损失钾肥 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.纯碱水解显碱性,促进油污的水解;
B.漂白粉中含有的次氯酸钙与空气中的CO2反应生成CaCO3和次氯酸,导致漂白粉变质;
C.难溶物的溶度积越小,溶解度越小,越容易生成沉淀;
D.K2CO3与NH4Cl混合发生双水解反应生成氨气,对钾离子没有影响.
解答 解:A.纯碱水解显碱性,促进油污的水解,温度越高越利于水解,则用热的纯碱溶液可洗去油污,但不能纯碱与油污直接反应,故A错误;
B.氯化钙不与二氧化碳反应,漂白粉变质的原因是次氯酸钙与空气中的CO2反应生成CaCO3和次氯酸,故B错误;
C.向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀,说明氢氧化铜更难溶,即Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2,故C正确;
D.碳酸根离子和铵根离子之间发生双水解反应,导致氮肥降低,而对钾离子没有影响,不会损失钾肥,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及盐的水解原理、难溶物溶解平衡等知识,明确盐的水解原理及其影响为解答关键,注意掌握难溶物溶解平衡及沉淀转化的本质,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
14.短周期元素a、b、c、d原子序数依次增大,a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族:下列说法错误的是( )
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | d的原子半径是这些元素中最大的 | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
15.下列有关实验的说法正确的是( )
| A. | 用pH试纸测双氧水的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性KMnO4溶液 | |
| C. | 用托盘天平称取 5.85 g NaCl晶体 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
12.利用下列装置不能完成对应实验的是( )
| A. |  实验室制取氨气 | B. | 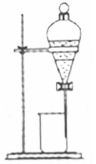 用CCl4萃取碘水中的碘 | ||
| C. | 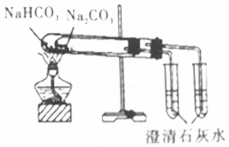 比较Na2CO3与NaHCO3的稳定性 | D. | 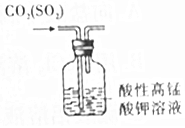 除去CO2中混有的少量SO2 |
19.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 干冰只能用于人工降雨 | |
| B. | Al(OH)3可以治疗胃酸过多,因此可大量使用 | |
| C. | 为了增强去污效果,在洗衣粉中添加三聚磷酸钠(Na5P3O10) | |
| D. | 侯氏制碱法不涉及基本反应类型中的置换反应 |
9.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 1L 0.1mol•L-1 NH4Cl溶液中Cl-的数目为0.1NA | |
| C. | 标准状况下,6.72L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量H2SO4溶液中水解得到的乙醇分子数为NA |
16.如表是短周期的一部分,Y原子的核电荷数是X的2倍,下列关于这四种元素的说法正确的是( )
| X | ||
| M | Y | Z |
| A. | 氢化物沸点最高的是H2X | B. | M4的摩尔质量为124 | ||
| C. | X、Y、Z的简单离子半径最大的是Z | D. | X、Y两种元素,化合价都可以显-1价 |
8.下列物质中,既能溶于强酸溶液又能溶于强碱溶液的氧化物是( )
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Al(OH)3 |
9.已知向0.005mol/LFeCl3中加入0.01mol/LKSCN溶液,溶液呈红色.在这个反应体系中存在下述平衡
Fe3++3SCN-(无色)?Fe(SCN)3(红色)
下列叙述错误的是( )
Fe3++3SCN-(无色)?Fe(SCN)3(红色)
下列叙述错误的是( )
| A. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会加深,因为OH-与Fe3+生成了红褐色沉淀 | |
| B. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会变浅,因为OH-与Fe3+生成了红褐色沉淀,使Fe3+的浓度减小,平衡逆向移动,导致Fe(SCN)3的浓度减小 | |
| C. | 向上述溶液中滴加几滴1 mol/L KSCN溶液,溶液颜色会加深,因为SCN-的浓度增大,正反应速率加快,平衡正向移动,导致导致Fe(SCN)3的浓度增大 | |
| D. | 向上述溶液中分别滴加NaOH溶液和KSCN溶液过程中,Na+、K+的浓度大小对平衡体系没有影响 |