题目内容
14.短周期元素a、b、c、d原子序数依次增大,a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族:下列说法错误的是( )| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | d的原子半径是这些元素中最大的 | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
分析 a的核外电子总数与其周期数相同,应为H元素,b的某种单质是空气的主要成分,可能为氮气或氧气,c的最外层电子数为其内层电子数的3倍,应为O元素,则b为N元素,d与c同族,则d为S元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:A.H可与O形成H2O、H2O2等,N可与O形成NO、NO2等化合物,S可与O形成SO2、SO3等化合物,故A正确;
B.S位于第三周期,原子半径S>N>O>H,故S半径为最大的,故B正确;
C.a与d形成的化合物为H2S,溶液呈酸性,可以抑制水的电离,故C正确;
D.如为NH4HSO4,则抑制水的电离,故D错误.
故选D.
点评 本题考查结构性质与位置关系、元素周期律等知识,题目难度中等,推断元素是解题的关键,注意明确原子结构与元素周期律之间的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.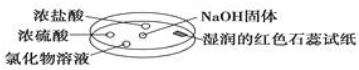 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |
2. 673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
 673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )| A. | c点的正反应速率与逆反应速率相等 | |
| B. | d点和e点的n(Z)不相等 | |
| C. | d点的反应速大于e点的反应速率 | |
| D. | 其他条件不变.将容器容积缩小到一半.反应至t1时刻.c(Y)比图中的d点大. |
9.现有FeO、Fe2O3、Fe3O4组成的混合物mg,向其中加入l00mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
6.合理利用燃料,减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 | |
| C. | 燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 | |
| D. | 甲烷是比较洁净的燃料,标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程 式可表示为 CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
3.设NA为阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 0.1molNaCl固体中含0.1NA个阳离子 | |
| B. | 22.4LCO2含有的原子数是3NA | |
| C. | 常温常压下,NA个H2质量为2g | |
| D. | 1molMg与足量O2反应,失去的电子数是2NA |
4.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应会损失钾肥 |
| A. | A | B. | B | C. | C | D. | D |