题目内容
15.下列有关实验的说法正确的是( )| A. | 用pH试纸测双氧水的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性KMnO4溶液 | |
| C. | 用托盘天平称取 5.85 g NaCl晶体 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
分析 A.双氧水具有强氧化性;
B.滴定管的感量为0.01mL,且高锰酸钾可氧化橡胶;
C.托盘天平的感量为0.1g;
D.Na2CO3溶液显碱性,与二氧化硅反应生成具有粘合性的硅酸钠.
解答 解:A.双氧水具有强氧化性,不能选pH试纸测定其pH,应选pH计,故A错误;
B.滴定管的感量为0.01mL,且高锰酸钾可氧化橡胶,则用酸式滴定管量取20.00 mL酸性KMnO4溶液,故B正确;
C.托盘天平的感量为0.1g,则托盘天平称取 5.8 g或5.9g NaCl晶体,故C错误;
D.Na2CO3溶液显碱性,与二氧化硅反应生成具有粘合性的硅酸钠,应选橡皮塞,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握pH的测定、仪器的使用、试剂的保存等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
5.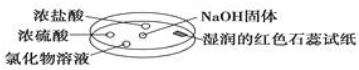 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |
6.合理利用燃料,减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 | |
| C. | 燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 | |
| D. | 甲烷是比较洁净的燃料,标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程 式可表示为 CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
3.设NA为阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 0.1molNaCl固体中含0.1NA个阳离子 | |
| B. | 22.4LCO2含有的原子数是3NA | |
| C. | 常温常压下,NA个H2质量为2g | |
| D. | 1molMg与足量O2反应,失去的电子数是2NA |
10.在无色强酸性溶液中,下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
7.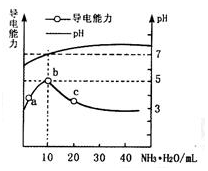 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | B. | b点溶液pH=7,此时酸碱恰好中和 | ||
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | D. | b、c两点水的电离程度:b<c |
4.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应会损失钾肥 |
| A. | A | B. | B | C. | C | D. | D |
