题目内容
9.在冶金工业上,均不能用热还原法制得的金属组是( )| A. | Na、Fe、Al | B. | Na、K、Zn | C. | Fe、Cu、Ag | D. | Na、Ca、K |
分析 金属冶炼的方法有:
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得;
据此分析解答.
解答 解:能用热还原法制得的金属性质较不活泼,如Zn、Fe、Sn、Pb、Cu等;
A.Na、Al都是活泼金属,用电解法制取,都不能用热还原反应制取,铁能够用热还原法制取,故A不选;
B.Na、K都是活泼金属,用电解法制取,都不能用热还原反应制取,锌能够用热还原法制取,故B不选;
C.Fe、Cu性质较不活泼,可以用热还原法制取,Ag性质稳定,用加热分解氧化物的方法制得,故C不选;
D.Na、Ca、K都是活泼金属,用电解法制取,都不能用热还原反应制取,故D选;
故选:D.
点评 本题考查金属冶炼的一般方法和原理,熟悉金属的活泼性与冶炼方法是解题关键,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
19.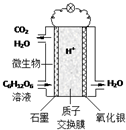 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
20.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)表中能形成两性氢氧化物的元素是铝(写元素名称),该元素在元素周期表中的位置是第三周期第ⅢA族,写出该元素对应氧化物与氢氧化钠反应的化学方程式NaOH+Al(OH)3═NaAlO2+2H2O.
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.(写化学式)
⑧⑨⑩对应的气态氢化物的稳定性从大到小的顺序是HF>HCl>HBr.(用化学式表示)
(3)元素⑦的氢化物电子式为 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
(4)判断元素④和⑧对应的常见单质氧化性的强弱Cl2>S(用化学式表示),并用化学方程式阐明你的判断:Na2S+Cl2=2NaCl+S.
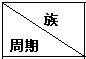 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑩ | |||||
| 三 | ① | ③ | ⑤ | ④ | ⑧ | ⑪ | ||
| 四 | ② | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.(写化学式)
⑧⑨⑩对应的气态氢化物的稳定性从大到小的顺序是HF>HCl>HBr.(用化学式表示)
(3)元素⑦的氢化物电子式为
 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)(4)判断元素④和⑧对应的常见单质氧化性的强弱Cl2>S(用化学式表示),并用化学方程式阐明你的判断:Na2S+Cl2=2NaCl+S.
17.下列化学键类型相同晶体类型也相同的是( )
| A. | 晶体SiO2与干冰 | B. | NaCl与HCl | C. | 金刚石和C60 | D. | NH4Cl与NaOH |
4.下列关于原电池的叙述中正确的是( )
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成 |
19.下列关于化学能转化为电能的四种装置的说法正确的是( )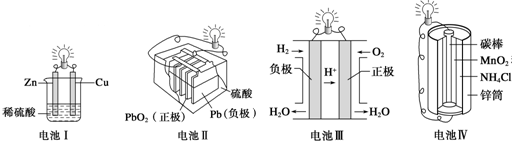

| A. | 电池Ⅰ中锌是负极 | |
| B. | 电池Ⅱ是一次电池 | |
| C. | 电池Ⅲ工作时氢气发生还原反应 | |
| D. | 电池Ⅳ工作时电子由锌通过导线流向碳棒 |
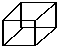 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线: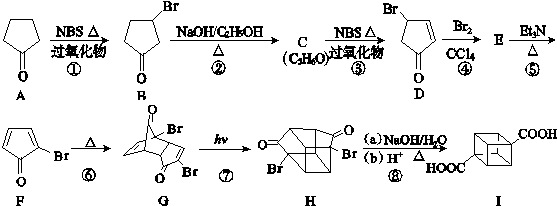
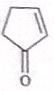 ,E的结构简式为
,E的结构简式为 .
.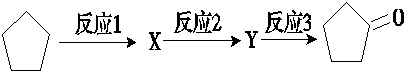
 ;
;