题目内容
4.下列关于原电池的叙述中正确的是( )| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成 |
分析 A、正极和负极可以是两种不同的金属,也可以是导电的非金属与金属;
B、原电池的负极,失去电子,发生氧化反应;
C、原电池的正极,得到电子,发生还原反应;
D、锌、铜和盐酸构成的原电池工作时,负极上金属锌质量减少,正极上氢离子得电子产生氢气,根据电池反应计算.
解答 解:A、原电池的正极和负极可以是两种不同的金属,也可以是导电的非金属与金属,故A错误;
B、原电池的负极,失去电子,正极得到电子,即电子流入的一极为正极,故B正确;
C、原电池的正极,得到电子,发生还原反应总反应式是氧化还原反应,故C错误;
D、锌、铜和盐酸构成的原电池工作时,负极上金属锌质量减少,正极上氢离子得电子产生氢气,电池反应Zn+2H+=Zn2++H2↑,有6.5g即0.1mol锌溶解,正极上就有0.1mol即0.2g氢气生成,故D错误.
故选B.
点评 本题考查原电池的工作原理,掌握氧化与还原反应的区别,注意电流的方向,与电子移动方向的不同.

练习册系列答案
相关题目
15.下列说法中错误的是( )
| A. | 需要加热才能发生的反应不一定是吸收热量的反应 | |
| B. | 科学家经常在金属与非金属的交界线处寻找良好的半导体材料 | |
| C. | 催化剂是影响化学反应速率和化学平衡的一个重要因素 | |
| D. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 |
9.在冶金工业上,均不能用热还原法制得的金属组是( )
| A. | Na、Fe、Al | B. | Na、K、Zn | C. | Fe、Cu、Ag | D. | Na、Ca、K |
16.法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关:“四中子”微粒的说法正确的( )
| A. | 该微粒的质量数为2 | |
| B. | 该微粒不显电性 | |
| C. | 它与普通中子互称为同位素 | |
| D. | 在元素周期表中与氢元素占同一位置 |
13.与 3-甲基-1-戊烯同属烯烃且主链为4个碳的同分异构体共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.含有共价键的分子晶体是( )
| A. | NaOH | B. | SiO2 | C. | Cl2 | D. | NH4Cl |

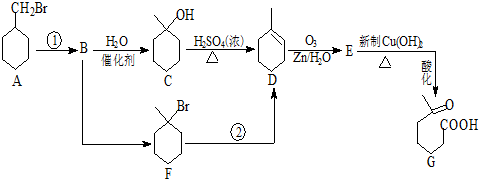
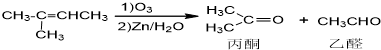
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.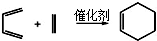
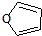 )也可以发生“Diels-Alder反应”,该化学方程式为:
)也可以发生“Diels-Alder反应”,该化学方程式为: .
.