题目内容
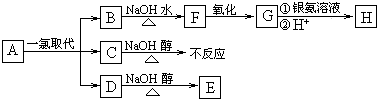
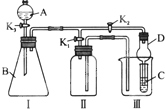 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开).
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是
(3)利用装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭).如要设计实验证明氧化性KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加
考点:制备实验方案的设计,实验装置综合,性质实验方案的设计
专题:实验设计题
分析:(1)分液漏斗中为液体,锥形瓶中为固体,该反应装置I不需要加热;
(2)装置Ⅰ、Ⅱ制取气体,为固体与液体反应制备密度比空气小的气体,且气体与氧气不能反应;
(3)装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭).如要设计实验证明氧化性KMnO4>Cl2>Br2,则I中发生高锰酸钾和浓盐酸的氧化还原反应,Ⅲ中发生氯气与NaBr的氧化还原反应,以此来解答.
(2)装置Ⅰ、Ⅱ制取气体,为固体与液体反应制备密度比空气小的气体,且气体与氧气不能反应;
(3)装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭).如要设计实验证明氧化性KMnO4>Cl2>Br2,则I中发生高锰酸钾和浓盐酸的氧化还原反应,Ⅲ中发生氯气与NaBr的氧化还原反应,以此来解答.
解答:
解:(1)装置Ⅰ制取气体,由图可知分液漏斗中为液体,锥形瓶中为固体,该反应装置I不需要加热,即生成气体的反应应具备的条件是固体与液体反应,且不需要加热,
故答案为:固体与液体反应,且不需要加热;
(2)装置Ⅰ、Ⅱ制取气体,为固体与液体反应制备密度比空气小的气体,且气体与氧气不能反应,则
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是氧气的密度比空气大,NO密度与空气接近,且NO和氧气反应;
乙同学简易改进也可收集O2和NO等气体,是因O2 和NO不能与水发生反应,而且难溶于水,所以能采用排水法收集;NO2和水能发生反应,反应为3NO2+H2O=NO+2HNO3,不能采用排水法收集,该装置不改变仪器装置,所以只能采用排水法收集,即装置II中加满水,
故答案为:氧气的密度比空气大,NO密度与空气接近,且NO和氧气反应;装置II中加满水;3NO2+H2O=NO+2HNO3;
(3)装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭).如要设计实验证明氧化性KMnO4>Cl2>Br2,则I中发生高锰酸钾和浓盐酸的氧化还原反应,Ⅲ中发生氯气与NaBr的氧化还原反应,由氧化性为氧化剂>氧化产物,则A中为浓盐酸,B中为KMnO4固体,C中为NaBr溶液,观察到C中的现象为溶液呈橙色,
故答案为:KMnO4固体;NaBr溶液;溶液呈橙色.
故答案为:固体与液体反应,且不需要加热;
(2)装置Ⅰ、Ⅱ制取气体,为固体与液体反应制备密度比空气小的气体,且气体与氧气不能反应,则
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是氧气的密度比空气大,NO密度与空气接近,且NO和氧气反应;
乙同学简易改进也可收集O2和NO等气体,是因O2 和NO不能与水发生反应,而且难溶于水,所以能采用排水法收集;NO2和水能发生反应,反应为3NO2+H2O=NO+2HNO3,不能采用排水法收集,该装置不改变仪器装置,所以只能采用排水法收集,即装置II中加满水,
故答案为:氧气的密度比空气大,NO密度与空气接近,且NO和氧气反应;装置II中加满水;3NO2+H2O=NO+2HNO3;
(3)装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭).如要设计实验证明氧化性KMnO4>Cl2>Br2,则I中发生高锰酸钾和浓盐酸的氧化还原反应,Ⅲ中发生氯气与NaBr的氧化还原反应,由氧化性为氧化剂>氧化产物,则A中为浓盐酸,B中为KMnO4固体,C中为NaBr溶液,观察到C中的现象为溶液呈橙色,
故答案为:KMnO4固体;NaBr溶液;溶液呈橙色.
点评:本题考查气体的制备及性质实验方案设计,为高频考点,把握气体的性质及密度选择相应的收集方法以及实验设计的方案的设计,侧重于考查学生对实验原理的把握和对仪器的使用,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列反应的离子方程式不正确的是( )
| A、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、硫酸铵溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、CO2通入过量氢氧化钠溶液中 CO2+2OH-═CO32-+H2O |
| D、CuO与盐酸反应:CuO+2H+═Cu2++H2O |
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+
O2(g)?SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
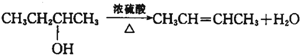
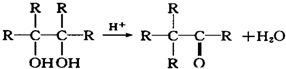

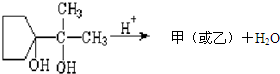
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
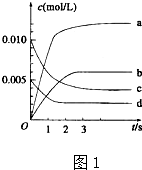 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.