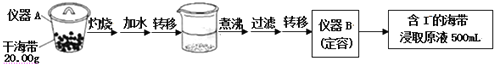
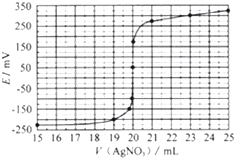
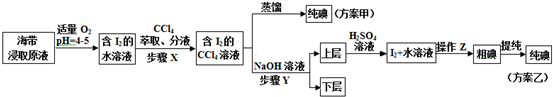
题目内容
12.芳香族化合物M是某虽白质的水解产物之一,经测定,M只含碳,氢,氧,氮四种元素,M的相对分子质量介于150与200之间,氧元素的质量分数约为19.4%,碳元素的质量分数约为65.5%,在M分子碳、氧原子个数之和等于氢原子数,进一步测定M只含有一个侧链;M分子含-NH2,M能和氢氧化钠溶液反应.M分于中官能团连接在同一个碳原子上,且不含甲基.根据上述信息.回答下列问题:(1)M的分子式为C9H11O2N.
(2)M所含官能团名称是
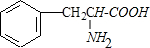 .
.(3)常温下,下列试剂中能和M反应的是ABC(填代号).
A.酸性高锰酸钾 B.氢气 C.碳酸氢钠溶液 D.银氨溶液
(4)M在一定条件下发生缩聚反应,生成高聚物的结构简式为
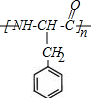 .
.(5)M在一定条件下自身发生反应生成的产物分子含3个六元环.写出相关化学方程式:2
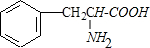 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$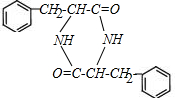 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).(6)W是M的同分异构体,W具有下列结构和性质:①苯环上只有一个侧链;②既能发生银镜反应,又能发生水解反应;③含-NH2.W的结构有3种.
分析 氧元素的质量分数约为19.4%,M的相对分子质量介于150与200之间,若相对分子量为150时,含有氧原子数为$\frac{150×19.4%}{16}$≈1.81,若M的相对分子量为200时,含有氧原子数为$\frac{200×19.4%}{16}$≈2.425,所以M分子中含有2个O原子,则M的相对分子量为:$\frac{16×2}{19.4%}$=165;碳元素的质量分数约为65.5%,则M分子中含有C原子数为:$\frac{165×65.5%}{12}$=9;在M分子碳、氧原子个数之和等于氢原子数,则M分子中含有H原子数为:9+2=11,M中含有N原子数为:$\frac{165-12×9-1×11-16×2}{14}$=1,所以M的分子式为:C9H11O2N;进一步测定M只含有一个侧链,M分子含-NH2,M能和氢氧化钠溶液反应,M分于中官能团连接在同一个碳原子上,且不含甲基,则M分子中含有羧基,其结构简式为: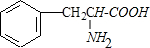 ,据此进行解答.
,据此进行解答.
解答 解:(1)氧元素的质量分数约为19.4%,M的相对分子质量介于150与200之间,若相对分子量为150时,含有氧原子数为$\frac{150×19.4%}{16}$≈1.81,若M的相对分子量为200时,含有氧原子数为$\frac{200×19.4%}{16}$≈2.425,所以M分子中含有2个O原子,则M的相对分子量为:$\frac{16×2}{19.4%}$=165;碳元素的质量分数约为65.5%,则M分子中含有C原子数为:$\frac{165×65.5%}{12}$=9;在M分子碳、氧原子个数之和等于氢原子数,则M分子中含有H原子数为:9+2=11,M中含有N原子数为:$\frac{165-12×9-1×11-16×2}{14}$=1,所以M的分子式为:C9H11O2N,
故答案为:C9H11O2N;
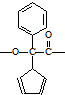
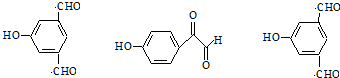
(2)M的分子式为C9H11O2N,M为芳香族化合物,则M分子中一定含有苯环;进一步测定M只含有一个侧链,M分子含-NH2,M能和氢氧化钠溶液反应,M分于中官能团连接在同一个碳原子上,且不含甲基,则M分子中含有羧基,其结构简式为: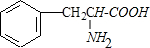 ,
,
故答案为: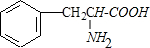 ;
;
(3)M的结构简式为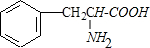 ,其分子中含有氨基和羧基,在一定条件下能够发生缩聚反应生成高聚物:
,其分子中含有氨基和羧基,在一定条件下能够发生缩聚反应生成高聚物: ,
,
故答案为: ;
;
(4)M在一定条件下自身发生反应生成的产物分子含3个六元环,说明两分子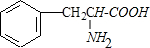 发生成成肽反应生成
发生成成肽反应生成 ,反应的化学方程式为:2
,反应的化学方程式为:2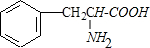 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O;
+2H2O;
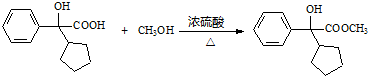
M分子中含有羧基,能够与乙醇发生酯化反应,该反应也属于取代反应,
故答案为:2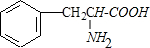 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O;酯化反应(取代反应);
+2H2O;酯化反应(取代反应);
(5)M为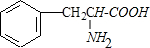 ,W是M的同分异构体,W具有下列结构和性质:①苯环上只有一个侧链;②既能发生银镜反应,又能发生水解反应,则W分子中含有醛基和酯基;而M中只含有2个O原子,则W为甲酸酯;③含-NH2,则满足条件的W苯环侧链有:-CH(NH2)CH2OOCH、-C(NH2)(CH3)-OOCH、-C(CH2NH2)OOCH,总共有3种结构,
,W是M的同分异构体,W具有下列结构和性质:①苯环上只有一个侧链;②既能发生银镜反应,又能发生水解反应,则W分子中含有醛基和酯基;而M中只含有2个O原子,则W为甲酸酯;③含-NH2,则满足条件的W苯环侧链有:-CH(NH2)CH2OOCH、-C(NH2)(CH3)-OOCH、-C(CH2NH2)OOCH,总共有3种结构,
故答案为:3.
点评 本题考查了有机推断,题目难度中等,正确推断M的分子式、结构简式为为解答关键,注意熟练掌握常见有机物结构与性质,试题充分考查了学生分析、理解能力及逻辑推理能力.

| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:
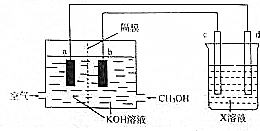
①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3 kJ•mol-1
H2O(1)═H2O(g),△H=+44.0 kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.09kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1 kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述反应的影响,某学习小组进行了以下三组对比实验温度为360℃或480℃、压强为101 kPa或303 kPa.
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
实验l、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.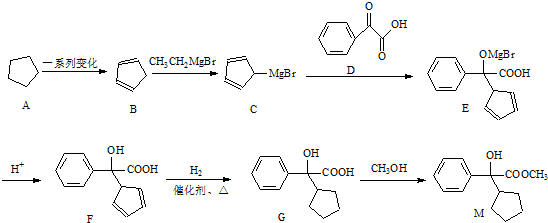
 .
. .
.