题目内容
17.随着环保意识增强,清洁能源越来越受到人们关注.(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3 kJ•mol-1
H2O(1)═H2O(g),△H=+44.0 kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.09kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1 kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述反应的影响,某学习小组进行了以下三组对比实验温度为360℃或480℃、压强为101 kPa或303 kPa.
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
实验l、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
分析 (1)已知:①.CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3 kJ•mol-1
②.H2O(1)═H2O(g),△H=+44.0 kJ•mol-l
根据盖斯定律,①-②×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-990.3 kJ•mol-1,再计算甲烷物质的量,结合热化学方程式计算放出的热量;
(2)①计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆) 相对大小;
②要研究温度对化学反应速率影响,则其它条件必须相同,则1、2的压强必须相同;要研究压强对反应速率影响,则其它条件必须相同,则温度必须相同;
化学平衡常数只与温度有关,与压强等其它因素无关.
解答 解:(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1,
②H2O(1)=H2O(g)△H=+44.0kJ•mol-1,
根据盖斯定律,①-②×2得,甲烷气体完全燃烧生成液态水的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,
所以4.8g甲烷气体的物质的量为$\frac{4.8g}{16g/mol}$=0.3mol,故完全燃烧生成液态水,放出热量为0.3mol×890.3kJ•mol-1=267.09kJ,
故答案为:267.09kJ;
(2)①此时浓度商Qc=$\frac{2×{2}^{3}}{3×8.5}$=0.63<平衡常数K=1,故反应向正反应进行,故v(正)>v(逆),
故选:a;
②根据表中数据知,1、3相比,其温度相同,研究的是压强对化学反应速率影响,1的反应速率大于3,所以1的压强大于3,所以P1为303kPa、P3为101kPa;
实验2、3的压强相同但温度不同,其目的是研究温度对化学反应速率的影响;
化学平衡常数只与温度有关,温度相同其平衡常数相同,该反应的正反应是吸热反应,所以升高温度平衡常数增大,则K1=K3<K2,
故答案为:303;101;研究温度对化学反应速率的影响;K1=K3<K2.
点评 本题考查化学平衡有关计算、探究反应速率影响因素、盖斯定律等知识点,为高频考点,侧重考查学生实验探究、总结归纳能力及计算能力,会根据浓度商与平衡常数相对大小确定反应方向,题目难度中等.

| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
| A. | 纯碱溶液显碱性,可用热的纯碱溶液除去金属表面的油污 | |
| B. | 明矾溶于水可形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| C. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| D. | 氢氧化铁的溶解度比氢氧化铜的小得多,可向硫酸铜溶液中加入氢氧化铁除去混有的Cu2+ |
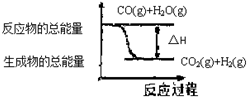
| A. | 依图象可知反应:CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 无法判断反应物总能量与生成物总能量的相对大小 | |
| C. | 表示此反应是吸热反应 | |
| D. | 此反应:△H>0 |
| A. | CO2的电子式: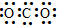 | B. | 碳原子最外层电子的轨道表示式: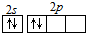 | ||
| C. | 淀粉分子的最简式:CH2O | D. | 乙烯分子的比例模型 |

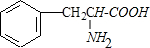 .
.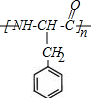 .
.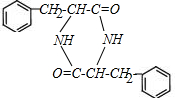 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
 (填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.
(填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.