题目内容
3.处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )| A. | 食物腐败变质 | B. | 浓硫酸在空气中体积增大 | ||
| C. | 铝表面形成致密的薄膜 | D. | 食醋洗掉水垢 |
分析 A.食物腐败发生缓慢氧化;
B.浓硫酸具有吸水性;
C.Al与氧气反应生成致密的氧化铝;
D.醋酸与水垢中碳酸钙反应.
解答 解:A.食物腐败发生缓慢氧化,发生氧化还原反应,故A不选;
B.浓硫酸具有吸水性,则浓硫酸在空气中体积增大,为物理变化,故B选;
C.Al与氧气反应生成致密的氧化铝,发生氧化还原反应,故C不选;
D.醋酸与水垢中碳酸钙反应,生成醋酸钙溶于水,则食醋可洗掉水垢,发生复分解反应,故D不选;
故选B.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
18.将气体A、B置于容积为2L的密闭容器中,发生反应:4A(g)+B(g)=2C(g)反应进行到4s末,测得C为0.2mol.则该反应速率v(C)为( )
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
15.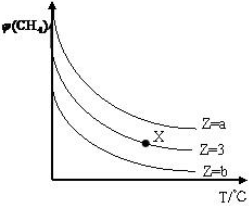 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
5.下列关于硬水及其软化的说法正确的是( )
| A. | 软水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-纯碱法中石灰是指CaCO3 | |
| C. | 石灰-纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度 | |
| D. | 离子交换剂不能再生 |
6.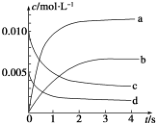 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v=1.5×10-3mol•L-1•s-1.若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是放热反应.
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.