题目内容
5.根据磷元素的原子结构示意图(如图所示),做出如下推理,其中与事实不符的是( )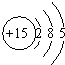
| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
分析 A.主族元素周期数=电子层数、主族族序数=最外层电子数;
B.金属元素名称一般有“钅”字旁,固态非金属元素名称有“石”字旁,气态非金属元素名称有“气”字头,据此进行解答;
C.非金属性越强,原子得电子能力越强;
D.P是第三周期第ⅤA族的元素,最高正价为+5价,据此分析其最高价氧化物的水化物化学式.
解答 解:A.P元素原子有3个电子层,最外层有5个电子,位于元素周期表的第三周期第ⅤA族,故A正确;
B.磷元素元素名称有“石”字旁,属于非金属元素,故B正确;
C.非金属性S>P,则磷原子不如氮原子和硫原子的得电子能力强,故C错误;
D.P是第三周期第ⅤA族的元素,最高正价等于最外层电子数,属于最高正价为+5价,所以最高价氧化物的水化物可以写成H3PO4或HPO3,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,把握元素周期律及非金属性的比较即可解答,题目难度不大.

练习册系列答案
相关题目
6.判断以下叙述正确的是CDEF
部分短周期元素的原子半径及主要化合价
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
7.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和盐酸;Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | NaHCO3和NaHSO4;Na2CO3和HNO3 | |
| D. | NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量) |
13.针对奥运会,国际奥委会提出要承办“绿色奥运”.那么,“绿色化学”在化学工业生产中是指( )
| A. | 在化工厂周围种绿色植物 | |
| B. | 不得排放废水、废气、废渣 | |
| C. | 以绿色植物为原料,用生物催化剂进行化工生产,且原子利用率达到100% | |
| D. | 尽可能减少对环境的污染 |
15.关于下列各装置图的叙述中,不正确的是( )
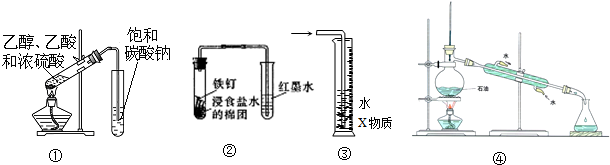

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可观察铁的吸氧腐蚀 | |
| C. | 装置③中X为四氯化碳,该装置可用于吸收氨气或氯化氢 | |
| D. | 装置④为实验室蒸馏石油装置 |