题目内容
20.高锰酸钾溶液常用于物质的定性检验与定量分析.(1)实验室里欲用KMnO4固体来配制250.00mL 0.1000mol•L-1的KMnO4酸性溶液.
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管.
②配制过程中玻璃棒所起的作用是搅拌、引流.
③下列操作对实验结果的影响偏大的是a(填序号).
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度.
①配平该反应的化学方程式:FeSO4+KMnO4+H2SO4═K2SO4+MnSO4+Fe2(SO4)3+H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和消耗掉的KMnO4溶液的体积.
分析 (1)①根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②在配制过程中,玻璃棒在溶解和移液的操作中用到;
③根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)①根据得失电子数相等来配平;
②根据反应可知,用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度的计算关系式为:C(Fe2+)•V(Fe2+)=5C(MnO4-)•V(MnO4-),据此分析.
解答 解:(1)①根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:天平、药匙、烧杯、玻璃棒、量筒、250mL容量瓶和胶头滴管,故答案为:250mL容量瓶;胶头滴管;
②在配制过程中,玻璃棒在溶解和移液的操作中用到,在溶解高锰酸钾固体时的作用是搅拌,加速溶解;在移液时的作用是引流,防止溶液溅出,故答案为:搅拌、引流;
③a.加水定容时俯视刻度线,则溶液体积偏小,故浓度偏高,故a正确;
b.容量瓶内壁附有水珠而未干燥处理,对溶液的浓度无影响,故b错误;
c.颠倒摇匀后发现凹液面低于刻度线是正常的,又加水补上,则溶液浓度偏低,故c错误.
故选a;
(2)①在反应中,Fe2+做还原剂,被氧化为+3价,1molFe2+失1mol电子;MnO4-做氧化剂,锰元素被还原为+2价,1molMnO4-得5mol电子,根据得失电子数相等来配平可有:10FeSO4+2KMnO4+8H2SO4=K2SO4+2 MnSO4+5Fe2(SO4)3+8H2O,
故答案为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2 MnSO4+5Fe2(SO4)3+8H2O;
②根据反应可知,用上述0.10000mol/L的酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度的计算关系式为:C(Fe2+)•V(Fe2+)=5C(MnO4-)•V(MnO4-),可知要想求出C(Fe2+),只需知道量取的FeSO4溶液的体积和测出消耗掉的KMnO4溶液的体积即可带入式子计算出C(Fe2+),
故答案为:消耗掉的KMnO4溶液的体积.
点评 本题考查了一定物质的量浓度溶液的配制和误差分析一种中和滴定,难度不大,注意实验的基本操作方法和注意事项.

 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | 油脂和蛋白质都属于高分子化合物 | |
| B. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | “地沟油”禁止食用,但可以用来制皂 |
| A. | 1mol氯气与足量水反应时转移的电子数为NA | |
| B. | 18g D2O中含有10NA个电子 | |
| C. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 1mol氯气与过量铁反应时转移的电子数为2NA |
| A. | CO和CH3OH | B. | CO2和 H2O | C. | H2和CO2 | D. | CH3OH和H2 |
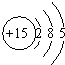
| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA |
 和
和
 和
和
 和
和
 和
和
 .
.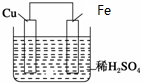 如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) .
.
 可简写为
可简写为 .玫瑰的香味物质中包含苧烯,苧烯的键线式如图
.玫瑰的香味物质中包含苧烯,苧烯的键线式如图 ,苧烯的分子式为C10H16.
,苧烯的分子式为C10H16.