题目内容
15.关于下列各装置图的叙述中,不正确的是( )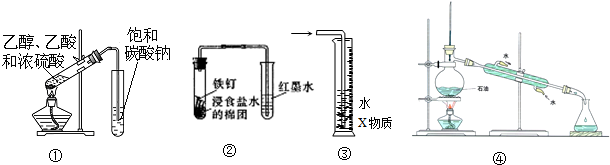
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可观察铁的吸氧腐蚀 | |
| C. | 装置③中X为四氯化碳,该装置可用于吸收氨气或氯化氢 | |
| D. | 装置④为实验室蒸馏石油装置 |
分析 A.导管不能插入液面以下,防止倒吸;
B.食盐水为中性,则Fe发生吸氧腐蚀;
C.氨气、氯化氢易溶于水,但不溶于四氯化碳;
D.蒸馏可用于分离沸点不同的混合物.
解答 解:A.乙酸乙酯中的乙酸、乙醇易溶于饱和碳酸钠溶液,导管不能插入液面以下,防止倒吸,故A错误;
B.食盐水为中性,则Fe发生吸氧腐蚀,图中装置正确,故B正确;
C.氨气、氯化氢为极性分子,易溶于水,难溶于四氯化碳,并且四氯化碳不溶于水,密度比水大,可用来防止倒吸,故C正确;
D.蒸馏可用于分离沸点不同的混合物,题中装置符合操作要求,故D正确.
故选A.
点评 本题考查化学实验方案的评价,涉及乙酸乙酯的制备、吸氧腐蚀、气体的收集以及物质的分离,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意装置及原理的关系,题目难度中等.

练习册系列答案
相关题目
5.根据磷元素的原子结构示意图(如图所示),做出如下推理,其中与事实不符的是( )
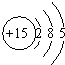
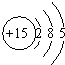
| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
6.关于青蒿素和双氢青蒿素(结构如图)的下列说法,错误的是( )
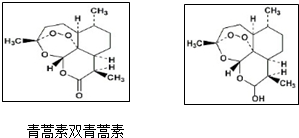

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
20.为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源.以下做法不能提高燃料效率的是( )
| A. | 煤的气化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 通入大量的空气 | D. | 将煤块粉碎 |
5.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)?4NO2(g)+O2(g)△H=+Q kJ/mol
一定温度时,向1L密闭容器中通入N2O5,部分实验数据见如表:
试计算【(2)(3)要有计算过程】
(1)计算前500s NO2的反应速率0.0006mol/(L•s)(不需计算过程)
(2)在一定温度下,该反应1000s时达到平衡,试计算该温度下平衡常数.
(3)在该温度下,如再向该密闭装置中通入0.25mol N2O5和0.375mol O2,请判断此时平衡的移动方向,并计算达平衡后N2O5的体积分数.
2N2O5(g)?4NO2(g)+O2(g)△H=+Q kJ/mol
一定温度时,向1L密闭容器中通入N2O5,部分实验数据见如表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| c(N2O5)(mol•L) | 0.50 | 0.35 | 0.25 | 0.25 |
(1)计算前500s NO2的反应速率0.0006mol/(L•s)(不需计算过程)
(2)在一定温度下,该反应1000s时达到平衡,试计算该温度下平衡常数.
(3)在该温度下,如再向该密闭装置中通入0.25mol N2O5和0.375mol O2,请判断此时平衡的移动方向,并计算达平衡后N2O5的体积分数.
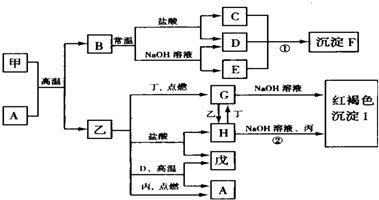 已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物.
已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物. ;
; .
.
 可简写为
可简写为 .玫瑰的香味物质中包含苧烯,苧烯的键线式如图
.玫瑰的香味物质中包含苧烯,苧烯的键线式如图 ,苧烯的分子式为C10H16.
,苧烯的分子式为C10H16. 与
与
 C:CH3COOH
C:CH3COOH