题目内容
下列推论正确的是( )
| A、S(g)+O2(g) SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2,则:△H1>△H2 |
| B、C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D、2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则碳的燃烧热等于110.5kJ/mol |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A.固体硫燃烧时要先变为气态硫,过程吸热,据此确定反应热的大小;
B.物质的能量越高越不稳定;
C.反应过程中,反应物的物质的量之比等于热量比;
D.1mol可燃物完全燃烧生成稳定的氧化物放出的热量为燃烧热.
B.物质的能量越高越不稳定;
C.反应过程中,反应物的物质的量之比等于热量比;
D.1mol可燃物完全燃烧生成稳定的氧化物放出的热量为燃烧热.
解答:
解:A.固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1<△H2;故A错误;
B.C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石的能量比石墨高,则石墨比金刚石稳定,故B错误;
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,即在稀溶液中1molNaOH完全反应放出57.4kJ热量,则:含20 gNaOH即0.5mol的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ,故C正确;
D.2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,该反应方程式中C的物质的量为2mol,生成的氧化物为CO不是稳定氧化物,所以反应热不是碳的燃烧热,故D错误.
故选C.
B.C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石的能量比石墨高,则石墨比金刚石稳定,故B错误;
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,即在稀溶液中1molNaOH完全反应放出57.4kJ热量,则:含20 gNaOH即0.5mol的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ,故C正确;
D.2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,该反应方程式中C的物质的量为2mol,生成的氧化物为CO不是稳定氧化物,所以反应热不是碳的燃烧热,故D错误.
故选C.
点评:本题考查了反应热大小比较、中和热、燃烧热等,侧重于基础知识的考查,题目难度不大,注意把握燃烧热和中和热的概念.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
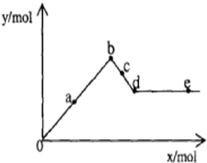 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
用铁片与稀硫酸反应制取氢气时,下列措施能使制取氢气生成速率加大的是( )
| A、降温 |
| B、不用稀硫酸,改用98%的浓硫酸 |
| C、不用稀硫酸,改用稀硝酸 |
| D、滴加少量CuSO4溶液 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、碳与二氧化碳在高温条件下反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、乙炔在O2中的燃烧 |
| D、氢氧化钠与稀盐酸反应 |
CaH2常作为生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是还原剂又是氧化剂 |
| D、既不是氧化剂又不是还原剂 |
下列表示溶液中发生反应的化学方程式错误的是( )
| A、100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 mol CH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- |
| B、向HCOOK和KOH混合溶液中加入KMnO4:2KMnO4+HCOOK+KOH═2K2MnO4+CO2 ↑+H2O |
| C、4mol/L 的NaAlO2溶液和7mol/L 的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
| D、在含有Mn2+的溶液中加入HNO3、再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |