题目内容
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、16g O3与16g O2含有相同的氧原子数 |
| B、2.3g Na+中含有的电子数为0.1NA |
| C、1mol O2所含的原子数为NA |
| D、2.4g镁变为Mg2+时失去的电子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据氧原子守恒计算分析;
B、依据n=
计算物质的量,结合钠离子电子数10计算;
C、氧气是双原子分子;
D、依据n=
计算物质的量,结合镁原子最外层2个电子分析.
B、依据n=
| m |
| M |
C、氧气是双原子分子;
D、依据n=
| m |
| M |
解答:
解:A、氧原子守恒,16g O3与16g O2含有氧元素质量相同,所含氧原子数相同,故A正确;
B、2.3g Na+中物质的量=
=0.1mol,含有的电子数为0.1mol×10×NA=NA,故B错误;
C、氧气是双原子分子,1mol O2所含的原子数为2NA,故C错误;
D、2.4g镁物质的量=
=0.1mol,镁原子最外层2个电子变为Mg2+时失去的电子数为0.2NA,故D错误;
故选A.
B、2.3g Na+中物质的量=
| 2.3g |
| 23g/mol |
C、氧气是双原子分子,1mol O2所含的原子数为2NA,故C错误;
D、2.4g镁物质的量=
| 2.4g |
| 24g/mol |
故选A.
点评:本题考查了阿伏伽德罗常数的分析应用主要是质量换算物质的量计算微粒数,注意微粒结构的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列食品添加剂与类别对应正确的一组是( )
| A、着色剂_______苯甲酸钠 |
| B、调味剂_______食盐 |
| C、营养强化剂_______亚硝酸钠 |
| D、防腐剂_______苋菜红 |
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法中正确的是( )
| A、工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益 |
| B、增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C、采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D、增大催化剂的表面积,能增大氨气的产率 |
下列有关实验的描述中错误的是( )
| A、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中溶液全部加热蒸干 |
| B、蒸馏操作时,应将温度计水银球置于蒸馏烧瓶的支管口附近 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、使用容量瓶和分液漏斗前,要先检查是否漏水后使用 |
下列化学方程式中,不能用H++OH-=H2O表示的是( )
| A、2NaOH+H2SO4=Na2SO4+2H2O |
| B、NaOH+HCl=NaCl+H2O |
| C、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| D、KOH+HCl=KCl+H2O |
下列各组中两种微粒所含电子数不相等的是( )
| A、H3O+和OH- |
| B、CO和N2 |
| C、HNO2和 NO2- |
| D、CH3+和NH4+ |
下列物质易溶于水的是( )
| A、硝酸钾 | B、氮气 |
| C、一氧化碳 | D、氯化银 |
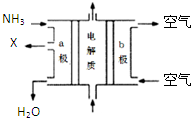 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.