题目内容
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法中正确的是( )
| A、工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益 |
| B、增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C、采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D、增大催化剂的表面积,能增大氨气的产率 |
考点:化学平衡的调控作用
专题:化学平衡专题
分析:A.温度低,催化剂的活性低反应速率慢;
B.固体的表面积越大,反应速率越大;
C.催化剂能降低反应的活化能;
D.催化剂不改变平衡.
B.固体的表面积越大,反应速率越大;
C.催化剂能降低反应的活化能;
D.催化剂不改变平衡.
解答:
解:A.温度低,催化剂的活性低反应速率慢,产量降低,所以不利于提高经济效益,故A错误;
B.固体的表面积越大,增大催化剂的表面积,能加快合成氨的正反应速率和逆反应速率,故B错误;
C.催化剂能降低反应的活化能,使活化分子的百分数增大,有效碰撞几率增大,反应速率加快,故C正确;
D.催化剂以及固体的表面积大小只能改变反应速率,不能改变平衡移动,所以氨气的产率不变,故D错误.
故选C.
B.固体的表面积越大,增大催化剂的表面积,能加快合成氨的正反应速率和逆反应速率,故B错误;
C.催化剂能降低反应的活化能,使活化分子的百分数增大,有效碰撞几率增大,反应速率加快,故C正确;
D.催化剂以及固体的表面积大小只能改变反应速率,不能改变平衡移动,所以氨气的产率不变,故D错误.
故选C.
点评:本题考查化学平衡的调控作用,注意把握化学平衡移动原理对工业生成的指导意义,学习中注意相关基础知识的学习和理解,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列电离方程式书写错误的是( )
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、H2SO4=H++SO42- |
| D、KClO3=K++ClO3- |
有机物W(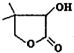 )常用于合成维生素类药物.下列与W相关说法正确的是( )
)常用于合成维生素类药物.下列与W相关说法正确的是( )
 )常用于合成维生素类药物.下列与W相关说法正确的是( )
)常用于合成维生素类药物.下列与W相关说法正确的是( )| A、分子式为C6H9O3 |
| B、分子中含有2种官能团 |
| C、分子中含有6种不同化学环境的氢原子 |
| D、水溶液中1mol W可与3mol NaOH完全反应 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、16g O3与16g O2含有相同的氧原子数 |
| B、2.3g Na+中含有的电子数为0.1NA |
| C、1mol O2所含的原子数为NA |
| D、2.4g镁变为Mg2+时失去的电子数为0.1NA |
下列实验操作正确的是( )
| A、分液时,分液漏斗中的两层液体均从下口放出 |
| B、蒸发食盐溶液,边加热边搅拌,直至把水蒸干得到干燥晶体 |
| C、称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 |
| D、配制稀硫酸,在烧杯中加水,沿着烧杯内壁缓慢加入浓硫酸,并用玻璃棒不断搅拌 |
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g?mL-1,质量分数为w,物质的量浓度为cmol?L-1,NA表示阿伏加德罗常数,则下列叙述正确的是( )
| A、所得溶液的物质的量浓度:c=1mol?L-1 | ||
| B、所得溶液中含有NA个HCl分子 | ||
| C、36.5g HCl气体在标准状况下占有的体积约为22.4L | ||
D、所得溶液的质量分数:w=36.5
|
其他条件不变,升高温度下列数据不一定增大的是( )
| A、水的离子积常数 |
| B、醋酸的电离平衡常数 |
| C、放热反应的正反应速率 |
| D、可逆反应的化学平衡常数 |
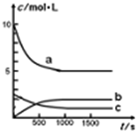 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示: