题目内容
10.相同物质的量浓度的下列物质的稀溶液中,pH最大的是( )| A. | 乙醇 | B. | 乙酸钠 | C. | 苯酚钠 | D. | 碳酸钠 |
分析 溶液酸性越强,溶液的pH越小,溶液碱性越强,溶液的pH越大;乙醇为中性溶液,乙酸钠、苯酚钠和碳酸钠都是强碱弱酸盐,碳酸钠的水解程度最大,则其溶液的pH最大,据此进行解答.
解答 解:乙醇不属于电解质,其溶解为中性;
乙酸钠、苯酚钠、碳酸钠都属于强碱弱酸盐,对应酸的酸性越强,酸根离子的水解程度越弱,则其溶液的pH越小,由于酸性:乙酸>苯酚>碳酸氢根离子,所以碳酸钠的水解程度最大,其溶液的pH也最大,
故选D.
点评 本题考查了盐的水解原理及其应用,题目难度不大,明确影响盐的水解的因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
1.25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.l000mol/L的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是( )
| 数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估算出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
18.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H22O3 | C. | C16H26O5 | D. | C16H20O3 |
5.下列实验合理的是( )

| A. | 得到红褐色沉淀 | B. | 吸收氨气,并防止倒吸 | ||
| C. | 制备并收集少量NO2气体 | D. | 实验室制O2 |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L F2所含原子数为0.1NA | |
| B. | 4.4gCO2中氧分子的个数为0.1NA | |
| C. | 78g Na2O2固体中Na+的个数目为NA | |
| D. | 2.3gNa完全燃烧后失去电子的个数为0.1NA |
2.六种短周期元素(a、b、c、d、e、f)的原子序数依次增大.其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料.由此可推知( )
| A. | a、c两种元素只能组成化学式为ca3的化合物 | |
| B. | b、c、d分别与a形成的简单化合物,沸点由高到低依次为:d>c>b | |
| C. | 原子半径由大到小的顺序是 e>f>c>b>a | |
| D. | 元素的非金属性由强到弱的顺序是 d>c>f>b |
19.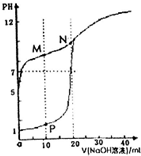 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.