题目内容
3.NA表示阿伏加罗常数的值,下列有关叙述错误的个数为( )①1mol苯乙烯中含有的碳碳双键数为4NA
②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA
③高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,每生成1mol Cl2转移的电子总数为2NA
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 ①苯乙烯中含有1条碳碳双键;
②4乙烯和丙烯的最简式均为CH2,且结构中均C-H键为极性键;
③求出 Fe的物质的量,然后根据铁与足量水蒸气完全反应变为+$\frac{8}{3}$来分析.
④溶液越稀,NH4+的水解程度越大;
⑤NO2和N2O4的最简式均为NO2;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量.
解答 解:①苯环中不含碳碳双键,故苯乙烯中含有1条碳碳双键,即1mol苯乙烯中含NA条碳碳双键,故①错误;
②乙烯和丙烯的最简式均为CH2,故4.2g混合物中含有的CH2的物质的量为0.3mol,且结构中均C-H键为极性键,故0.3molCH2中含0.6NA条极性键,故②正确;
③16.8gFe的物质的量为0.3mol,而铁与足量水蒸气完全反应变为+$\frac{8}{3}$,故0.3mol铁转移0.8NA个电子,故③正确.
④溶液越稀,NH4+的水解程度越大,故1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目前者多,故④错误;
⑤NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含0.3NA个原子,故⑤正确;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气,故当生成1mol氯气时转移$\frac{5}{3}$NA个电子,故⑥错误;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量,而氯气反应后变为-1价,故1mol氯气得2NA个电子,则铁失去2NA个电子,故⑦错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

 阅读快车系列答案
阅读快车系列答案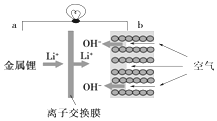
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
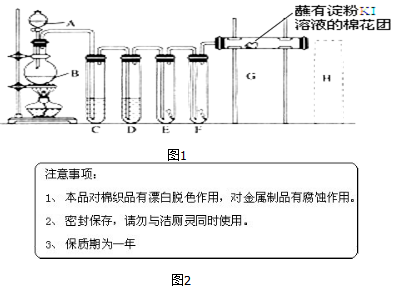
 .
.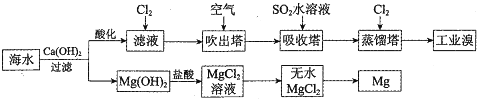
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
 .
.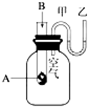 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: