题目内容
1.在含有c(NH4Cl)=3c(AlCl3)的溶液中滴加一定量的稀NaOH溶液,则下列离子方程式不符合实际反应情况的是( )| A. | Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O | |
| B. | 2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O | |
| C. | Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O | |
| D. | Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O |
分析 氨根离子、铝离子都与氢氧化钠反应,氢氧化钠先与铝离子反应生成氢氧化铝,然后再与氨根离子反应生成一水合氨,再加入氢氧化钠,氢氧化钠与氢氧化铝反应生成偏铝酸钠;在含c(NH4Cl)=3c(AlCl3)的溶液中,氨根离子与铝离子物质的量之比为3:1,设铵根离子和铝离子分别为3mol、1mol,依据氢氧化钠加入的量书写离子方程式.
解答 解:在含c(NH4Cl)=3c(AlCl3)的溶液中,氨根离子与铝离子物质的量之比为3:1,设铵根离子和铝离子分别为3mol、1mol,
A.向溶液中加入6molNaOH时,氢氧化钠先与铝离子反应生成氢氧化铝,然后再与氨根离子反应生成一水合氨,则反应的离子方程式可以为:Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O,故A正确;
B.当加入3.5molNaOH时,1mol铝离子消耗3mol氢氧化钠,剩余的0.5mol氢氧根离子消耗0.5mol铵根离子,反应的离子方程式为:2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O,故B正确;
C.当加入7mol氢氧化钠时,铵根离子和铝离子完全反应,铝离子转化成偏铝酸根离子,反应的离子方程式为:Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O,故C正确;
D.反应Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O中铝离子与铵根离子的物质的量之比为1:5,而实际溶液中铝离子与铵根离子物质的量之比为1:3,不可能发生该反应,故D错误;
故选D.
点评 本题考查了离子方程式的书写,侧重考查反应物用量对反应的影响,明确氨根离子、铝离子与氢氧化钠反应的顺序是解题关键,题目难度较大.

练习册系列答案
相关题目
1.安顺某消防支队成功处理了一起液氨槽罐车爆炸泄露事故.下列有关液氨的说法正确的是( )
| A. | 液氨是离子化合物 | B. | 液氨是共价化合物 | ||
| C. | 液氨分子中含离子键 | D. | 一个液氨分子中含有7个电子 |
12.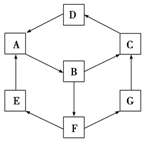 如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
②
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;B也能将一种氧化物氧化为F,F是含有三种元素的化合物,稀的F溶液与A反应生成E、G.
根据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为;G与次氯酸反应的离子方程式为H++2Fe2++HClO═2Fe3++Cl-+H2O.
 如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.②
| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
根据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为;G与次氯酸反应的离子方程式为H++2Fe2++HClO═2Fe3++Cl-+H2O.
16.下列仪器常用于物质分离的是( )
①漏斗
②试管
③蒸馏烧瓶
④天平
⑤分液漏斗
⑥研钵.
①漏斗
②试管
③蒸馏烧瓶
④天平
⑤分液漏斗
⑥研钵.
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ①②⑥ |
6.下列有关NaClO2和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,Fe2+、NH4+、SO42-、S2-可以大量共存 | |
| B. | 该溶液中,H+、K+、NO3-、SO42-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓硫酸,反应的离子方程式为:ClO2-+4H++3 Cl-=2Cl2↑+2 H2O |
11.如图是一种新型锂电池原理图,下列有关叙述正确的是( )
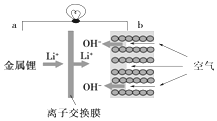

| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
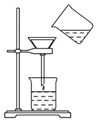 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
 .
.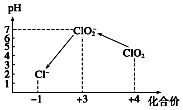 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.