题目内容
12.溴化碘(IBr)的化学性质很像卤素单质,它能与大多数金属、非金属化合生成卤化物,还 能与水发生反应,下列有关 IBr 的叙述不正确的是( )| A. | IBr 与 AgNO3 溶液反应会生成浅黄色沉淀 | |
| B. | IBr 与水反应属于氧化还原反应,IBr 既作氧化剂又作还原剂 | |
| C. | IBr 属于共价化合物 | |
| D. | 反应 IBr+2Na=NaBr+NaI 中,每反应 2mol Na,电子转移数目为 2NA |
分析 A.IBr在溶液中发生电离,溴离子与硝酸银反应;
B.IBr 与水反应属,生成HBr、HIO,无元素的化合价变化;
C.IBr中只含I-Br键;
D.IBr+2Na=NaBr+NaI 中,Na元素的化合价升高,I元素的化合价降低.
解答 解:A.IBr在溶液中发生电离,溴离子与硝酸银反应生成AgBr沉淀,则会生成浅黄色沉淀,故A正确;
B.IBr 与水反应属,生成HBr、HIO,无元素的化合价变化,则为非氧化还原反应,故B错误;
C.IBr中只含I-Br键,含两种元素,为共价化合物,故C正确;
D.IBr+2Na=NaBr+NaI 中,Na元素的化合价由0升高为+1价,由Na元素的化合价变化可知,每反应 2mol Na,电子转移数目为 2NA,故D正确;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质不能作为食品添加剂的是( )
| A. | 食盐 | B. | 蔗糖 | C. | 香料 | D. | 福尔马林 |
3.下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀 | 证明氢氧化铝不溶于过量的氢氧化钡溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.元素X、Y、Z、W、Q、M在元素周期表的相对位置如表所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是( )
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点Y>Q是因为Y的非金属性比Q强 | |
| B. | XM4的比例模型为  其二氢取代物有两种 其二氢取代物有两种 | |
| C. | W的氧化物,常温下可以和Z、M的氢化物反应 | |
| D. | Z的单质能将Y的单质从其氢化物中置换出来 |
7.下列过程放出热量的是( )
| A. | 冰的融化 | B. | 水的分解 | C. | 硝酸铵溶于水 | D. | 浓硫酸稀释 |
17.等物质的量的甲烷和氯气组成的混合气体,经过长时间的光照,最后得到的产物有几种( )
| A. | 1 种 | B. | 2 种 | C. | 4 种 | D. | 5 种 |
4.在卤代烃R-CH2-CH2-X中化学键如图所示,则下列说法正确的是( )
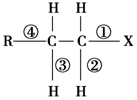

| A. | 发生水解反应时,被破坏的键是④ | |
| B. | 发生消去反应时,被破坏的键是①和② | |
| C. | 发生水解反应时,被破坏的键是①和④ | |
| D. | 发生消去反应时,被破坏的键是①和③ |
1.下列有关说法正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| C. | 1.12 L Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 过量的铁粉与氯气反应生成FeCl3 |
12.下列有关实验的说法正确的是( )
| A. | 将SO2通入溴水中,溴水褪色证明SO2具有漂白性 | |
| B. | 将含有少量HCl的Cl2通入水中以除去HCl杂质 | |
| C. | 将乙烯通入酸性KMnO4溶液中,溶液褪色证明乙烯具有还原性 | |
| D. | 将蔗糖溶液和少量稀H2SO4混合加热后,加入新制的Cu(OH)2检验蔗糖是否水解 |