题目内容
12.下列有关实验的说法正确的是( )| A. | 将SO2通入溴水中,溴水褪色证明SO2具有漂白性 | |
| B. | 将含有少量HCl的Cl2通入水中以除去HCl杂质 | |
| C. | 将乙烯通入酸性KMnO4溶液中,溶液褪色证明乙烯具有还原性 | |
| D. | 将蔗糖溶液和少量稀H2SO4混合加热后,加入新制的Cu(OH)2检验蔗糖是否水解 |
分析 A.二氧化硫和溴水发生氧化还原反应;
B.氯化氢易溶于水;
C.乙烯含有碳碳双键,可被高锰酸钾氧化;
D.蔗糖在酸性条件下水解,水解产物在碱性条件下与新制的Cu(OH)2反应.
解答 解:A.二氧化硫和溴水发生氧化还原反应,二氧化硫表现还原性,故A错误;
B.氯气难溶于饱和食盐水,而氯化氢易溶于水,应用饱和食盐水,故B错误;
C.乙烯含有碳碳双键,可被高锰酸钾氧化,可证明乙烯具有还原性,故C正确;
D.蔗糖在酸性条件下水解,水解产物在碱性条件下与新制的Cu(OH)2反应,水解后应先调节溶液至碱性,故D错误.
故选C.
点评 本题考查较为综合,涉及混合物分离提纯以及物质的检验,为高频考点,把握物质的性质、性质差异及发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.溴化碘(IBr)的化学性质很像卤素单质,它能与大多数金属、非金属化合生成卤化物,还 能与水发生反应,下列有关 IBr 的叙述不正确的是( )
| A. | IBr 与 AgNO3 溶液反应会生成浅黄色沉淀 | |
| B. | IBr 与水反应属于氧化还原反应,IBr 既作氧化剂又作还原剂 | |
| C. | IBr 属于共价化合物 | |
| D. | 反应 IBr+2Na=NaBr+NaI 中,每反应 2mol Na,电子转移数目为 2NA |
3.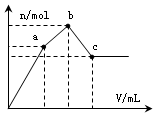 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点对应的沉淀,其物质的量为0.01mol | |
| B. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| C. | 沉淀质量最大值为4.66g | |
| D. | c点加入Ba(OH)2溶液的体积为250 mL |
7.铅蓄电池是机动车上常用的化学电源,其两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列结论正确的是( )
| A. | Pb为正极被氧化 | B. | PbO2为负极被氧化Pb | ||
| C. | 电解质溶液浓度不断减小 | D. | 溶液的PH不断减小 |
4.下列关于有机化学实验的说法正确的是( )
| A. | 除去苯中的甲苯,可使用酸性 KMnO4和 NaOH,然后分液 | |
| B. | 除去乙醇中混有的少量乙酸,加 NaOH 溶液,然后分液 | |
| C. | 检验溴乙烷中溴元素,直接加入硝酸银溶液生成浅黄色沉淀 | |
| D. | 实验室制备乙烯时,产生的气体直接通入溴水,溴水褪色,证明有乙烯生成 |
1.某有机物的结构如下:CH2(OH)CH=CHCH2COOH,这种有机物不可能具有的性质是( )
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加聚反应
⑥能发生水解反应.
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加聚反应
⑥能发生水解反应.
| A. | ①④ | B. | 只有⑥ | C. | 只有⑤ | D. | ④⑥ |
6.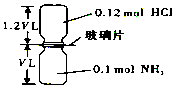 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42g | |
| C. | 生成物的分子数目为0.1NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |