题目内容
3.下述实验操作与预期实验目的或所得实验结论不一致的是( )| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀 | 证明氢氧化铝不溶于过量的氢氧化钡溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2气体通入紫色石蕊试液,溶液变红;
B.再滴加几滴饱和FeCl3溶液,铁离子浓度增大,向生成络离子的方向移动;
C.2NO2?N2O4 △H<0,低温时颜色浅;
D.硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀,最终为硫酸钡沉淀.
解答 解:A.SO2气体通入紫色石蕊试液,溶液变红,与二氧化硫为酸性氧化物有关,与漂白性无关,故A错误;
B.再滴加几滴饱和FeCl3溶液,铁离子浓度增大,向生成络离子的方向移动,则颜色加深,可探究增大反应物浓度时平衡移动的方向,故B正确;
C.2NO2?N2O4 △H<0,低温时颜色浅,则可探究温度对化学平衡的影响,故C正确;
D.硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀,最终为硫酸钡沉淀,不能说明氢氧化铝不溶于过量的氢氧化钡溶液,故D错误;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、化学平衡、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率减慢的是( )
| A. | 向稀硫酸中加水 | B. | 增加锌粒的量 | C. | 用锌粉代替锌粒 | D. | 升高反应温度 |
18.环丙烷叉环丙烷结构为: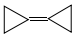 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 不可能是环丙烷的同系物 | ||
| C. | 与环己二烯(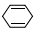 )是同分异构体 )是同分异构体 | D. | 所有的原子均在同一平面内 |
15. A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
 A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )| A. | 简单离子半径:D离子>C离子>A离子>B离子 | |
| B. | D元素氧化物的水化物一定是强酸 | |
| C. | B、C的简单离子都能破坏水的电离平衡 | |
| D. | 氢化物还原性:C>D |
12.溴化碘(IBr)的化学性质很像卤素单质,它能与大多数金属、非金属化合生成卤化物,还 能与水发生反应,下列有关 IBr 的叙述不正确的是( )
| A. | IBr 与 AgNO3 溶液反应会生成浅黄色沉淀 | |
| B. | IBr 与水反应属于氧化还原反应,IBr 既作氧化剂又作还原剂 | |
| C. | IBr 属于共价化合物 | |
| D. | 反应 IBr+2Na=NaBr+NaI 中,每反应 2mol Na,电子转移数目为 2NA |
3.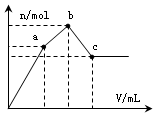 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点对应的沉淀,其物质的量为0.01mol | |
| B. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| C. | 沉淀质量最大值为4.66g | |
| D. | c点加入Ba(OH)2溶液的体积为250 mL |
