题目内容
1.下列有关说法正确的是( )| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| C. | 1.12 L Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 过量的铁粉与氯气反应生成FeCl3 |
分析 A.NaClO是强电解质;
B.Cl2具有很强的氧化性,氯气与水反应生成盐酸和次氯酸,氯气既是氧化剂也是还原剂;
C.状况不知,无法由体积求物质的量;
D.无论氯气是否过量,铁在氯气中燃烧都生成FeCl3;
解答 解:A.HClO是弱酸,NaClO在水溶液里或熔融状态下完全电离,所以NaClO是强电解质,故A错误;
B.Cl2具有很强的氧化性,氯气与水反应生成盐酸和次氯酸,氯气既是氧化剂也是还原剂,而不是只作氧化剂,故B错误;
C.状况不知,无法由体积求物质的量,所以质子数不知,故C错误;
D.氯气具有强氧化性,无论氯气是否过量,铁在氯气中燃烧都生成FeCl3,故D正确;
故选D.
点评 本题考查较综合,涉及强弱电解质的判断、氯气的性质、物质的量的计算等知识点,根据物质的性质来分析解答即可,题目难度不大.

练习册系列答案
相关题目
12.溴化碘(IBr)的化学性质很像卤素单质,它能与大多数金属、非金属化合生成卤化物,还 能与水发生反应,下列有关 IBr 的叙述不正确的是( )
| A. | IBr 与 AgNO3 溶液反应会生成浅黄色沉淀 | |
| B. | IBr 与水反应属于氧化还原反应,IBr 既作氧化剂又作还原剂 | |
| C. | IBr 属于共价化合物 | |
| D. | 反应 IBr+2Na=NaBr+NaI 中,每反应 2mol Na,电子转移数目为 2NA |
9.生活离不开化学.下列对生活中各种物质的认识不正确的是( )
| A. | 普通肥皂的主要成分是高级脂肪酸钠盐 | |
| B. | 利用氢化反应将液态植物油转变为固态反式脂肪酸的过程发生的是还原反应 | |
| C. | “皮革奶粉”含有大量有毒物质,不能食用 | |
| D. | 沾有血迹的衣物要用热水和加酶洗衣粉浸泡 |
6.对下列事实的解释正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | 分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同 | |
| C. | 向50 mL 18 mol•L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
3.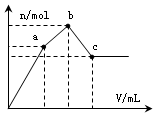 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点对应的沉淀,其物质的量为0.01mol | |
| B. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| C. | 沉淀质量最大值为4.66g | |
| D. | c点加入Ba(OH)2溶液的体积为250 mL |
 .
.