题目内容
13.下列各组分子中,都属于含有极性键的非极性分子的是( )| A. | CO2、H2S | B. | H2O2、C3H6 | C. | C2H4、CH4 | D. | NH3、HCl |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.CO2含有C=O,为极性键,二氧化碳是直线分子,呈对称结构,是非极性分子;H2S含有S-H,为极性键,水是V型分子,是极性分子,故A错误;
B.H2O2中含有氧氧非极性键和氧氢极性键,但是极性分子,C3H6分子中含有碳碳非极性键和碳氢极性键,但是极性分子,故B错误;
C.CH4和C2H4都含有C-H,是极性键,甲烷是正四面体结构,乙烯分子结构是平面对称型结构,二者正负电荷重心都能重合,都是非极性分子,故C正确;
D.HCl是由极性键构成的双原子极性分子,NH3为三角锥形结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故D错误;
故选C.
点评 本题考查键的极性和分子的极性的判断,题目难度中等,注意共价键极性和分子极性的判断方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.现有短周期元素X、Y、Z、M,已知X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是Z>Y>M | |
| D. | X与Z可以形成原子个数比1:1的化合物 |
4.在不同浓度(c)、温度(T)条件下,蔗糖发生水解反应(已知水解反应为吸热反应)的瞬时速率(v)如下表.下列判断不正确的是( )
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 不同温度时,蔗糖浓度减少一半所需的时间相同 | |
| C. | b<318.2 | |
| D. | 同时改变反应温度和蔗糖的浓度,v可能不变 |
1.从下列事实所得出的相应结论错误的是( )
| 实验事实 | 结论 | |
| A | 向某溶液中滴入2滴KSCN溶液,溶液不显血红色.再向溶液中滴入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl,2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>2ClO3->IO3- |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
8.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
3.实验室保存下列试剂的方法不正确的是( )
| A. | 钠保存在煤油中 | |
| B. | 用棕色试剂瓶盛放新制的氯水 | |
| C. | 冷的浓硝酸不能用钢瓶保存 | |
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.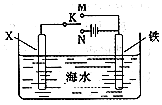 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.