题目内容
6.向体积相同的MgSO4、CuSO4、Fe2(SO4)3溶液加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,则上述三种溶液的物质的量浓度之比为( )| A. | 9:6:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
分析 结合MgSO4~2NaOH、CuSO4~2NaOH、Fe2(SO4)3~6NaOH及n=cV计算.
解答 解:加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,
设NaOH的浓度为1mol/L,消耗体积分别为3L、2L、1L,
则消耗NaOH分别为3mol、2mol、1mol,
由MgSO4~2NaOH、CuSO4~2NaOH、Fe2(SO4)3~6NaOH可知,
消耗MgSO4、CuSO4、Fe2(SO4)3的物质的量分别为1.5mol、1mol、$\frac{1}{6}$mol,
溶液体积相同,则浓度之比等于物质的量比,为1.5mol:1mol:$\frac{1}{6}$mol=9:6:1,
故选A.
点评 本题考查物质的量浓度的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意关系式法的应用,题目难度不大.

练习册系列答案
相关题目
12.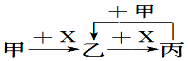 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
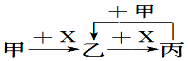 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )| A. | C和O2 | B. | CO2和NaOH溶液 | ||
| C. | Cl2和Fe | D. | AlCl3溶液和NaOH溶液 |
13.下列实验装置能达到相应实验目的是( )
| A. | 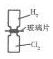 利用如图装置可将H2和Cl2均匀混合 | |
| B. | 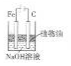 利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
10.将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是( )
| A. | Al2O3+OH-→AlO2-+H2O | B. | 2Al3++6OH-→2Al(OH)3↓ | ||
| C. | 2Al+2OH-+2H2O→2AlO2-+3H2↑ | D. | 2Al+6H2O→2Al3++6OH-+3H2↑ |
1.设NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数为0.5NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 在一定条件下,2mol浓H2SO4与足量的铜充分反应,转移的电子数目为2NA |
11.N4O6是一种新型的火箭推进剂中的氧化剂,燃烧时发生反应N4O6+3N2H4═5N2+6H2O,下列说法正确的是( )
| A. | N4O6的摩尔质量是152 | |
| B. | 该反应为复分解反应 | |
| C. | N4O6为离子化合物 | |
| D. | 该反应中生成标准状况下11.2L N2,转移的电子数为1.2NA |
18.某同学将金属钠露置于空气中,观察到下列现象:银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色晶体$\stackrel{⑤}{→}$白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )
| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
15.下列说法正确的是 ( )
| A. | 强电解质溶液一定比弱电解质溶液的导电性强 | |
| B. | 强电解质的稀溶液中不存在溶质分子 | |
| C. | 弱电解质不一定都是共价化合物 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度就相同 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |