题目内容
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
分析 A、求出重水的物质的量,然后根据重水中含10个质子来分析;
B、过氧化钠和水反应时,1mol过氧化钠转移1mol电子,生成0.5mol氧气;
C、在HF溶液中,除了HF中含共价键外,水中也含共价键;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、20g重水的物质的量为1mol,而重水中含10个质子,故1mol重水中含10NA个质子,故A正确;
B、过氧化钠和水反应时,1mol过氧化钠转移1mol电子,生成0.5mol氧气,即转移NA个电子,生成的氧气在标况下的体积为11.2L,故B错误;
C、在HF溶液中,除了HF中含共价键外,水中也含共价键,故溶液中含有的共价键个数多于0.1NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故NA个氢氧化铁胶粒中含有的氢氧化铁的物质的量多于1mol,则质量大于107g,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
6.向体积相同的MgSO4、CuSO4、Fe2(SO4)3溶液加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,则上述三种溶液的物质的量浓度之比为( )
| A. | 9:6:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
7.已知下列物质的溶度积常数如下表:
下列沉淀可能溶解于盐酸的是( )
| 物质 | HgS | Ag2S | MnS | CuS |
| 溶度积常数 | 6.4×10-53 | 6.3×10-50 | 2.5×10-13 | 1.3×10-36 |
| A. | HgS | B. | Ag2S | C. | MnS | D. | CuS |
4.下列有关物质的保存方法不正确的是( )
| A. | 浓氨水、浓硝酸应保存在棕色试剂瓶中,并置于阴凉处 | |
| B. | 液溴易挥发,应保存在棕色试剂瓶中,并加水封 | |
| C. | 在储存铵态化肥时,应密封包装并放在阴凉通风处 | |
| D. | 碘易升华,应保存在棕色细口瓶中,并置于阴凉处 |
11.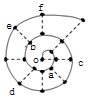 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
1.下列叙述正确的是( )
| A. | 取等体积、pH相同的醋酸和盐酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n | |
| B. | 将pH=2的CH3COOH溶液加水稀释,水的电离平衡也向右移动 | |
| C. | 常温下,将pH=2的H2SO4与pH=12的NH3•H2O溶液等体积混合后,混合液pH<7 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
5.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | H2SO4 | C. | SO2 | D. | NaCl |
6.下列各组离子能大量共存的是( )
| A. | 无色溶液中:Na+、Cu2+、NO3-、Cl- | |
| B. | 在pH=4的溶液中:Na+、K+、OH-、Cl- | |
| C. | 在含Ba2+的溶液中:H+、Na+、Cl-、SO42- | |
| D. | 与Fe反应产生气体的溶液:Na+、K+、Cl-、SO42- |