题目内容
18.表是元素周期表一部分,列出了九种元素在周期表中的位置:| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程
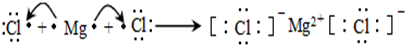 .
.(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:
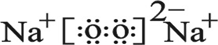 ,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
分析 由元素在周期表中的位置可知,①为Na,②为K,③为Mg,④为Al,⑤为C,⑥为N,⑦为O,⑧为F,⑨为Cl,
(1)周期表中F的非金属性最强,电子层越多,原子半径越大,同周期原子序数大的原子半径小;
(2)高氯酸为所有含氧酸中酸性最强的酸,①和④的最高价氧化物对应的水化物反应生成偏铝酸钠和水;
(3)③和⑨形成的化合物为氯化镁,为离子化合物;
(4)①和⑦可以形成一种淡黄色物质X为过氧化钠,与水反应时,过氧化钠为氧化剂也为还原剂.
解答 解:由元素在周期表中的位置可知,①为Na,②为K,③为Mg,④为Al,⑤为C,⑥为N,⑦为O,⑧为F,⑨为Cl,
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg,故答案为:F;Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4.①和④的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:HClO4;Al(OH)3+OH-═AlO2-+2H2O;
(3)③和⑨形成的化合物为氯化镁,为离子化合物,电子式表示形成过程为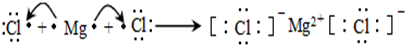 ,
,
故答案为: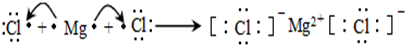 ;
;
(4)①和⑦可以形成一种淡黄色物质X为过氧化钠,其电子式为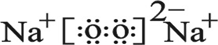 ,含离子键和共价键,0.1mol X与水反应转移电子数为0.1NA,
,含离子键和共价键,0.1mol X与水反应转移电子数为0.1NA,
故答案为: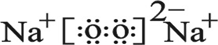 ;离子键和共价键;0.1NA.
;离子键和共价键;0.1NA.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意元素化合物及化学用语应用,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
9.下列说法正确的是( )
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取分液 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在 |
6.下列关于有机化合物的说法正确的是( )
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 糖类、油脂和蛋白质均可发生水解反应 | |
| D. | 油脂皂化反应得到高级脂肪酸盐与甘油 |
13.下列分子式只表示一种纯净物的是( )
| A. | C2H4O2 | B. | C3H6 | C. | CH2O | D. | C5H12 |
10.鉴别下列各组物质所用方法或试剂不可靠的是 ( )
| A. | 用酸性高锰酸钾溶液鉴别直馏汽油与裂化汽油 | |
| B. | 用溴水鉴别苯、甲苯 | |
| C. | 用燃烧方法鉴别聚乙烯、聚氯乙烯 | |
| D. | 用溴水鉴别苯、硝基苯和苯乙烯 |
7.近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图所示,下列说法正确的是( )

| A. | 苹果酸发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸与3molNaOH发生中和反应 | |
| C. | 1mol苹果酸与足量Na反应放出1molH2 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |

 .
. .
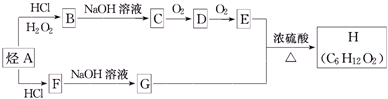
.
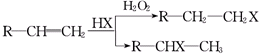 (X为卤素原子)
(X为卤素原子)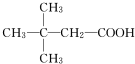 (用结构简式表示).
(用结构简式表示).