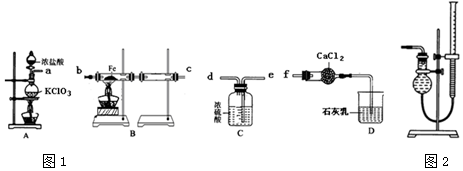
题目内容
19.下列说法正确的是( )| A. | 实验室中将钠保存于煤油或石蜡油中 | |
| B. | 金属镁着火使用泡沫灭火器灭火 | |
| C. | 用湿润的淀粉-KI试纸鉴别NO2和溴蒸气 | |
| D. | 配制一定物质的量浓度的溶液时,向容量瓶中倒入液体至刻度线 |
分析 A.钠性质活泼,密度小于煤油,应隔绝空气保存;
B.镁能在二氧化碳中燃烧;
C.二氧化氮、溴都具有强的氧化性;
D.依据定容的正确操作解答.
解答 解:A.钠性质活泼,放于煤油或石蜡油中,可以隔绝空气,故A正确;
B.镁能在二氧化碳中燃烧,所以不能用泡沫灭火器来灭火,应用沙子扑灭,故B错误;
C.二氧化氮、溴都具有强的氧化性,都能使湿润的淀粉-KI试纸,所以不能用湿润的淀粉-KI试纸鉴别,故C错误;
D.配制一定物质的量浓度的溶液时,向容量瓶中倒入液体,然后加入蒸馏水到离刻度线1-2cm时改用胶头滴管逐滴滴加直到凹液面最低处与刻度线相切,故D错误;
故选:A.
点评 本题考查了化学实验基本知识,涉及试剂的保存、物质的鉴别、溶液的配制等,侧重于学生对实验原理及常识的考查,难度不大,注意基础知识的积累.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
10.已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )
| A. | 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度 | |
| B. | 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3-+Ba2++2OH-?BaSO3↓+2H2O+SO32- | |
| C. | 滴加过程中,溶液中白色沉淀不断增加 | |
| D. | 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+) |
7.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 操作方法 |
| A | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 |
| B | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 |
| C | 除去Cl2中少量HCl | 将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关同位素的说法正确的是( )
| A. | 18O的中子数为8 | B. | 16O和18O质子数相差2 | ||
| C. | 16O与18O核电荷数相等 | D. | 1个16O与1个18O质量相等 |
11.下列离子方程式与所述事实相符且正确的是( )
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
8.下列关于乙炔的化学用语正确的是( )
| A. | 摩尔质量:26 | B. | 球棍模型: | C. | 电子式: | D. | 结构式:CH≡CH |
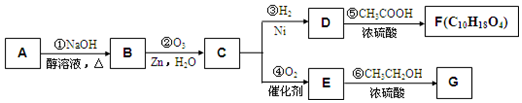
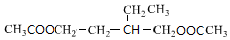 ,E
,E .
.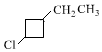 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$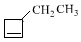 +NaBr+H2O,C→D
+NaBr+H2O,C→D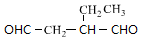 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$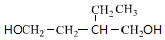 .
.