题目内容
20.用18.4mol/L的浓硫酸配制100mL 1mol/L的稀硫酸,有下列仪器:A.100mL量筒 B.10mL量筒 C.50mL烧杯 D.玻璃棒 E.托盘天平F.100mL容量瓶G.胶头滴管
(1)配制过程中需要用到的仪器有BCDFG
(2)下列操作,对最后所得溶液的物质的量浓度有无影响(填偏高、偏低、不变)
①将浓硫酸稀释后立即注入容量瓶,最后所得溶液的物质的量浓度偏高
②容量瓶中有少量蒸馏水,最后所得溶液的物质的量浓度不变
③摇匀后发现液面低于刻度线,又加水到刻度线,最后所得溶液的物质的量浓度偏低.
分析 (1)根据实验操作的步骤(计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作)确定所用仪器来解答;
(2)根据c=$\frac{n}{V}$进行分析:
①浓硫酸稀释后放出大量的热,未冷却至室温就转移入容量瓶,导致所配溶液体积偏小;
②容量瓶最后需要用水定容;
③摇匀后发现液面低于刻度线是正常的.
解答 解:(1)用18.4mol/L的浓硫酸配制100mL 1mol/L的稀硫酸的顺序是:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,
根据c(浓硫酸)×V(浓硫酸)=c(稀硫酸)×V(稀硫酸)计算浓硫酸的体积,18.4mol/L×V(浓硫酸)=1mol/L×0.1L,V(浓硫酸)=0.005L=5mL,则用10mL量筒量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以仪器有10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:BCDFG;
(2)根据c=$\frac{n}{V}$进行分析:
①浓硫酸稀释后放出大量的热,未冷却至室温就转移入容量瓶,导致所配溶液体积偏小,所配溶液的浓度偏高,故答案为:偏高;
②容量瓶中有少量蒸馏水,对配制溶液无影响,故答案为:不变;
③摇匀后发现液面低于刻度线是正常的,再加水则浓度偏低,故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制步骤以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
10.某粒子用${\;}_{Z}^{A}$Rn-表示,下列关于该粒子的叙述正确的是( )
| A. | 所含质子数=Z-n | B. | 所含中子数=A-Z+n | ||
| C. | 质量数=A+n | D. | 所含电子数=Z+n |
11.向纯水中加入少量NaHSO4固体,当温度不变时,则该溶液中( )
| A. | 水电离出的c(H+) 减小 | B. | c(OH-) 与 c(H+) 的乘积增大 | ||
| C. | c(H+ ) 减小 | D. | c(OH-) 增大 |
8.向含有下列某种阴离子的溶液中加入一小块钠,其离子数目会减少的是( )
| A. | CO32- | B. | HCO3- | C. | OH- | D. | Cl- |
15.下列说法中正确的是( )
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
12.下列各项中表达正确的是( )
| A. | 次氟酸的结构式为H-F-O | B. | CH4分子的球棍模型: | ||
| C. | 1H、3H2、D互为同位素 | D. | CO2电子式 |
9.下列各组物质所含化学键类型完全相同的是( )
| A. | HCl和NH4Cl | B. | CaH2和Na2O2 | C. | NaOH和MgCl2 | D. | H2O2和C2H6 |
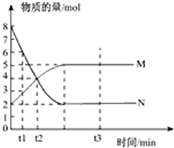 一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: