题目内容
14.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
分析 A、NaAlO2 水溶液中除了NaAlO2 含有氧原子,水中也含氧原子;
B、氢气为双原子分子;
C、氯气和水的反应为可逆反应;
D、Fe3+是弱碱阳离子,在溶液中会水解.
解答 解:A、NaAlO2 水溶液中除了NaAlO2 含有氧原子,水中也含氧原子,故溶液中的含有的氧原子的个数大于2NA个,故A错误;
B、氢气为双原子分子,故含有NA个原子的氢气的物质的量为0.5mol,在标况下的体积为11.2L,故B错误;
C、氯气和水的反应为可逆反应,故不能进行完全,则转移的电子数小于0.2NA个,故C错误;
D、Fe3+是弱碱阳离子,在溶液中会水解,故当溶液中Fe3+的个数为NA时,Cl-的数目大于3NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
5.在我们的日常生活中出现了的“增铁酱油”,这里的铁应理解为( )
| A. | 铁的氢氧化物 | B. | 铁的氧化物 | C. | 铁元素 | D. | 铁屑 |
2.关于下列各实验装置的叙述中,不正确的是( )


| A. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| B. | 装置②可用于收集H2、Cl2等气体 | |
| C. | 装置③可用于有关NH3实验的尾气处理 | |
| D. | 装置④可用于洗涤BaSO4淀表面吸附的少量氯化钠 |
9.在反应X+2Y═2R+M中,已知R和M的摩尔质量之比为22:9,当1.7g X与Y完全反应后,生成4.4g R.则在此反应中Y和R的质量之比为( )
| A. | 16:9 | B. | 9:11 | C. | 32:9 | D. | 46:9 |
19.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,所得溶液Q中的c(Fe3+):c(Fe2+)=2:3,下列有关说法中正确的是( )
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
6.下列说法正确的是( )
| A. | 淀粉、油脂、纤维素均为高分子有机物 | |
| B. | 酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖溶液 | |
| D. | 分子 所有碳原子一定不能共平面 所有碳原子一定不能共平面 |
3.下列说法正确的是( )
| A. | 已知ag乙烯气体充分燃烧时生成1molCO2和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量数值小于270kJ | |
| C. | 常温常压下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0kJ•mol-1 则C(s,金刚石)═C(s,石墨)△H=-1.5kJ•mol-1 |
4.已知反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列有关该反应的图象及叙述正确的是( )
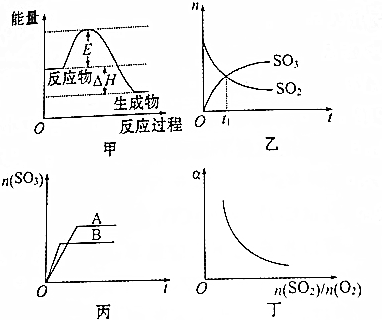

| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.