题目内容
12.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )| A. | PCl3 | B. | Cl2 | C. | N2 | D. | HBr |
分析 根据原子最外层电子数和化合价判断,在共价化合物中,各原子最外层电子数=原子的价层电子数+|化合价|,据此对各选项进行判断.
解答 解:A.PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故A不选;
B.Cl2分子中,Cl原子最外层电子数为:7+1=8,满足8电子稳定结构,故B不选;
C.N2中,N原子的最外层电子为:5+3=8,满足8电子稳定结构,故C不选;
D.HBr分子中,H原子最外层电子数为1+1=2,不满足8电子稳定结构,故D选;
故选D.
点评 本题考查了原子核外电子排布,题目难度不大,明确判断共价化合物分子中核外电子数的方法为解答关键,注意掌握原子核外电子排布规律,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2. 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是5 (填实验序号).
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
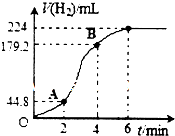
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
3.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 金属钠与固态水分别受热熔化 | B. | 氯化铵与苯分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 碘与干冰分别受热变为气体 |
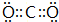 ,
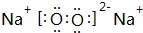
,
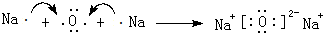 .
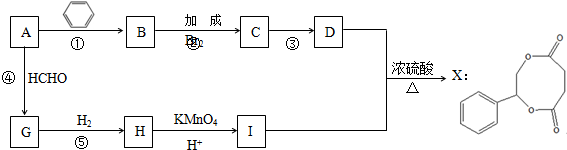
.
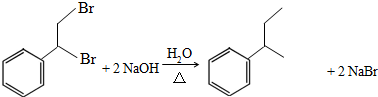 .
.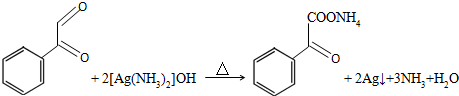 .
.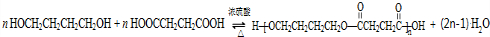 .
. 任意2种.
任意2种.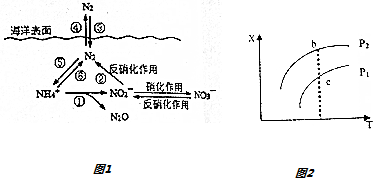
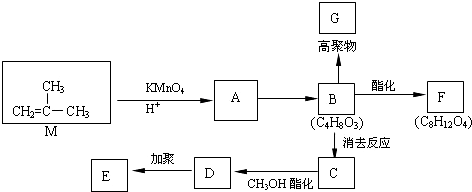
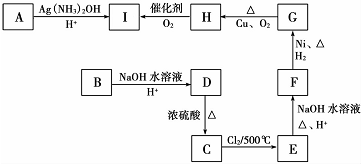
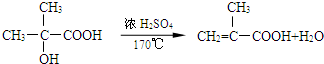 .②D→E的化学方程式
.②D→E的化学方程式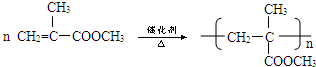 .
. ,
,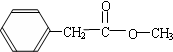 等.
等.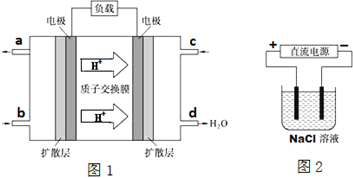
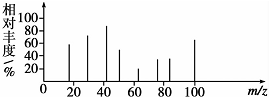
 、HOCH2CH2CH2CH2COOH.
、HOCH2CH2CH2CH2COOH. 、
、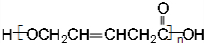 .
.