题目内容
4.以M为原料合成高分子化合物E和G.已知烯烃可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2$\underset{\stackrel{KMn{O}_{4}}{→}}{{H}^{+}}$HOCH2CH2OH.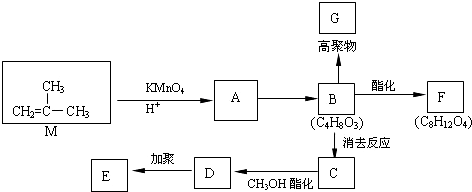
(1)有机物M的名称为2-甲基丙烯;C中的官能团名称是碳碳双键、羧基;A→B的反应类型是氧化反应
(2)①B→C的化学方程式
 .②D→E的化学方程式
.②D→E的化学方程式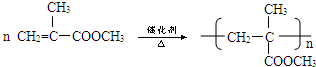 .
.(3)分子式为C9H10O2的芳香族化合物,属于酯类且只有一个侧连的同分异构体有6种,请写出任意两种的结构简式
 ,
,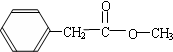 等.
等.
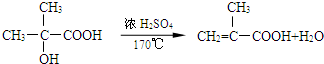
分析  被酸性高锰酸钾氧化生成A为
被酸性高锰酸钾氧化生成A为 ,由A、B分子式可知A发生氧化反应生成B为
,由A、B分子式可知A发生氧化反应生成B为 ,B发生缩聚反应生成G为
,B发生缩聚反应生成G为 ,由B、F分子式可知,2分子B发生酯化反应生成环酯F,则F为
,由B、F分子式可知,2分子B发生酯化反应生成环酯F,则F为 .B发生消去反应生成C为
.B发生消去反应生成C为 ,C与甲醇发生酯化反应生成D为
,C与甲醇发生酯化反应生成D为 ,D发生加聚反应生成E为
,D发生加聚反应生成E为 ,据此解答.
,据此解答.
解答 解: 被酸性高锰酸钾氧化生成A为
被酸性高锰酸钾氧化生成A为 ,由A、B分子式可知A发生氧化反应生成B为
,由A、B分子式可知A发生氧化反应生成B为 ,B发生缩聚反应生成G为
,B发生缩聚反应生成G为 ,由B、F分子式可知,2分子B发生酯化反应生成环酯F,则F为
,由B、F分子式可知,2分子B发生酯化反应生成环酯F,则F为 .B发生消去反应生成C为
.B发生消去反应生成C为 ,C与甲醇发生酯化反应生成D为
,C与甲醇发生酯化反应生成D为 ,D发生加聚反应生成E为
,D发生加聚反应生成E为 .
.
(1)有机物M( )的名称为:2-甲基丙烯;C为
)的名称为:2-甲基丙烯;C为 ,含有的官能团名称是:碳碳双键、羧基;A→B的反应类型是:氧化反应,
,含有的官能团名称是:碳碳双键、羧基;A→B的反应类型是:氧化反应,
故答案为:2-甲基丙烯;碳碳双键、羧基;氧化反应;
(2)①B→C的化学方程式为: ;
;
②D→E的化学方程式为: ,
,
故答案为: ;
; ;
;
(3)分子式为C9H10O2的芳香族化合物,属于酯类且只有一个侧链,符合条件的同分异构体有: ,
,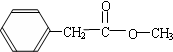 ,
, ,
, ,
, ,
,
故答案为:6; ,
,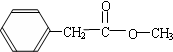 ,
, ,
, ,
, ,
, 任意2种.
任意2种.
点评 本题考查有机物推断、有机物命名、官能团、同分异构体等,注意根据反应条件及分子式进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
14.酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)滴定过程中操作滴定管的图1示正确的是A.
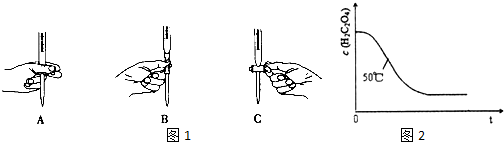
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
(4)写出表中a 对应的实验目的探究温度不同对反应速率的影响;若50℃时,草酸浓度c(H2C2O4)随反应时间t的变化曲线如图2所示,保持其他条件不变,请在图中画出25℃时c(H2C2O4)随t的变化曲线示意图.
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论.甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间.
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)滴定过程中操作滴定管的图1示正确的是A.

(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
12.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
| A. | PCl3 | B. | Cl2 | C. | N2 | D. | HBr |
16.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g);△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:
下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
13.下列说法中正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种 | |
| C. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| D. | 乙酸乙酯中的少量乙酸可用NaOH溶液除去 |

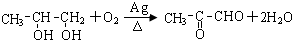 .
.
 .
. 片段
片段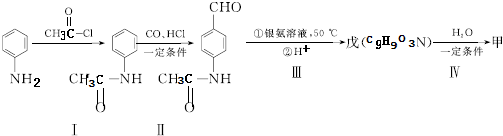
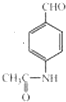 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$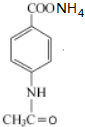 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.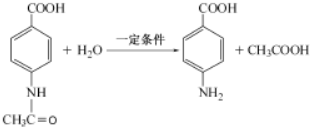 .
.
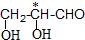 标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.
标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.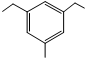 结构.有4种;写出其中一种的结构简式
结构.有4种;写出其中一种的结构简式 任意一种.
任意一种.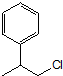 为原料合成
为原料合成 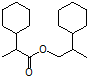 ,写出其合成路线(指明所用试剂和反应条件).
,写出其合成路线(指明所用试剂和反应条件).