题目内容
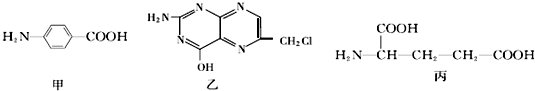
7.烃A是一种重要的化工原料,采用以下路线合成X.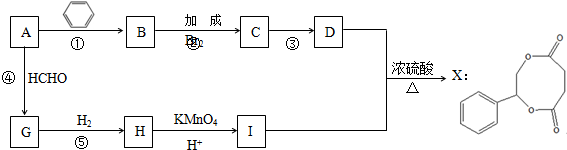
已知:RC≡CH+HCHO$\stackrel{一定条件}{→}$RC≡CCH2OH
请回答下列问题:
(1)若反应①、②、④的原子利用率均为100%,则A的名称为:乙炔.
(2)物质G的结构简式为:HOCH2C≡CCH2OH.
(3)写出反应③的化学反应方程式:
 .
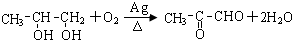
.(4)物质E是物质D发生催化氧化后生成的有机产物,请写出E与银氨溶液反应的化学方程式:
 .
.(5)物质H和物质I可以在一定条件下合成链状聚合物,请写出化学方程式:
 .
.(6)符合下列条件的D的同分异构体共有6种,请写出任意2种结构简式
 任意2种.
任意2种.ⅰ.与FeCl3溶液能发生显色反应
ⅱ.苯环上的一氯代物只有一种.
分析 由X的结构简式可知,D、I分别为 、HOOCCH2CH2COOH中的一种,而H被酸性高锰酸钾溶液氧化生成I,故D为
、HOOCCH2CH2COOH中的一种,而H被酸性高锰酸钾溶液氧化生成I,故D为 ,I为HOOCCH2CH2COOH.反应①、②、④的原子利用率均为100%,则均属于加成反应,则烃A为HC≡CH,B为
,I为HOOCCH2CH2COOH.反应①、②、④的原子利用率均为100%,则均属于加成反应,则烃A为HC≡CH,B为 ,C为
,C为 ,G为HOCH2C≡CCH2OH,H为HOCH2CH2CH2CH2OH.
,G为HOCH2C≡CCH2OH,H为HOCH2CH2CH2CH2OH.
解答 解:由X的结构简式可知,D、I分别为 、HOOCCH2CH2COOH中的一种,而H被酸性高锰酸钾溶液氧化生成I,故D为
、HOOCCH2CH2COOH中的一种,而H被酸性高锰酸钾溶液氧化生成I,故D为 ,I为HOOCCH2CH2COOH.反应①、②、④的原子利用率均为100%,则均属于加成反应,则烃A为HC≡CH,B为
,I为HOOCCH2CH2COOH.反应①、②、④的原子利用率均为100%,则均属于加成反应,则烃A为HC≡CH,B为 ,C为
,C为 ,G为HOCH2C≡CCH2OH,H为HOCH2CH2CH2CH2OH.
,G为HOCH2C≡CCH2OH,H为HOCH2CH2CH2CH2OH.
(1)由上述分析可知,烃A为HC≡CH,则A的名称为:乙炔,
故答案为:乙炔;
(2)由上述分析可知,物质G的结构简式为:HOCH2C≡CCH2OH,
故答案为:HOCH2C≡CCH2OH;
(3)反应③的化学反应方程式: ,
,
故答案为: ;
;
(4)物质E是物质D发生催化氧化后生成的有机产物,则E为 ,E与银氨溶液反应的化学方程式:
,E与银氨溶液反应的化学方程式: ,
,
故答案为: ;
;
(5)物质H和物质I可以在一定条件下合成链状聚合物,化学方程式为: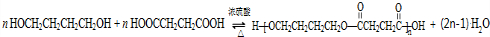 ,
,
故答案为: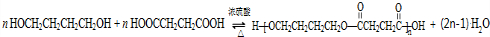 ;
;
(6)D为 ,D的同分异构体符合:ⅰ.与FeCl3溶液能发生显色反应,说明含有酚羟基,ⅱ.苯环上的一氯代物只有一种,符合条件的同分异构体有:
,D的同分异构体符合:ⅰ.与FeCl3溶液能发生显色反应,说明含有酚羟基,ⅱ.苯环上的一氯代物只有一种,符合条件的同分异构体有: ,
,
故答案为:6; 任意2种.
任意2种.
点评 本题考查有机物的推断与合成,根据X的结构简式采取正逆推法相结合进行推断,侧重考查学生分析推理能力,(6)中同分异构体书写为易错点,熟练掌握官能团的性质与转化.

练习册系列答案
相关题目
15.乳酸的结构简式如图,对乳酸的化学性质推测不正确的是( )
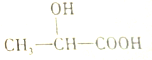
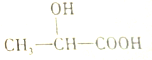
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成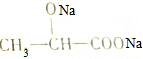 |
18.下列描述中,不符合生产实际的是( )
| A. | 电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝 | |
| B. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| C. | 在镀件上电镀锌,用锌作阳极,镀件作阴极 | |
| D. | 电解法精炼粗铜,用纯铜作阳极,粗铜阴极,CuSO4溶液为电解液 |
2.已知X、Y、Z、R均为短周期元素,其中X与R为同族元素,且X的元素原子序数是R原子序数的2倍,X、Y处于同一周期,Y的原子半径是本周期元素原子中最大的,Z元素是所有元素中非金属性最强的元素.下列说法不正确的是( )
| A. | 原子最外层电子数:Z>X=R>Y | |
| B. | Z与R形成的化合物中R显正价 | |
| C. | 离子半径:X2->Y+>R2->Z- | |
| D. | 四种元素中X元素形成的氢化物沸点最低 |
12.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
| A. | PCl3 | B. | Cl2 | C. | N2 | D. | HBr |
16.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g);△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:
下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |

 .
.
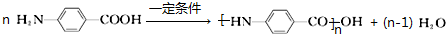
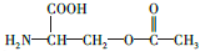 .
.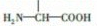 片段
片段
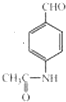 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$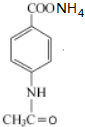 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.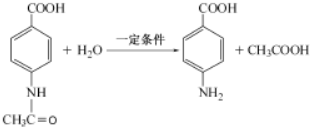 .
. ,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
,分子中非金属元素电负性由大到小的顺序为O、N、C、H.