题目内容
1.2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等.(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是c(填序号);
A.泡沫灭火器 B.消防车喷水 C.沙土
其中固体NaH与水反应的方程式为NaH+H2O=NaOH+H2↑.
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤.
①其水溶液呈强碱性,故俗称硫化碱.
②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为1:1.
(3)以上易燃液体甲醇是一种可再生能源,具有开发和应用的广阔前景,如:
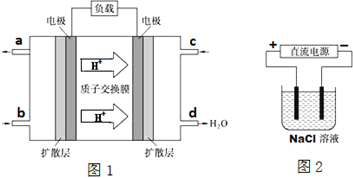
①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为O2+4e-+4H+=2H2O;负极的电极反应式CH3OH-6e-+H2O=CO2+6H+;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有1.2NA个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是铝棒 (填铝棒或碳棒);试写出电解该溶液总反应化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$H2+Cl2+2NaOH.
分析 (1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,据此回答;氢化钠与水反应生成氢氧化钠和氢气;
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂;
(3)①由氢离子移动方向知,右侧电极为正极,正极通入氧气,即c口通入的物质为氧气,氧气获得电子与氢离子结合生成水,左侧电极为负极,负极上通入燃料甲醇,甲醇失去电子,生成二氧化碳与氢离子;
根据n=$\frac{m}{M}$计算甲醇物质的量,再根据碳元素化合价变化计算转移电子;
②模拟氯碱工业,若只有铝棒和碳棒两个电极,铝棒作阴极、碳棒作阳极,电解氯化钠溶液生成氢氧化钠、氢气与氯气.
解答 解:(1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,件数钠着火,可以用沙土扑灭,故选C;
氢化钠与水反应生成氢氧化钠和氢气,化学方程式:NaH+H2O=NaOH+H2↑;
故答案为:c; NaH+H2O=NaOH+H2↑;
(2)反应2Na2S+2O2+H2O=Na2S2O3+2NaOH中O2中O化合价降低,所以其为氧化剂,Na2S中S元素的化合价升高,为还原剂,根据得失电子守恒,该反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
(3))①由氢离子移动方向知,右侧电极为正极,正极通入氧气,即c口通入的物质为氧气,正极电极反应式为:O2+4e-+4H+=2H2O,左侧电极为负极,负极上通入燃料甲醇,负极电极反应式为:CH3OH+H2O-6e-═CO2+6H+;
当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=$\frac{6.4g}{32g/mol}$×6=1.2mol,则转移电子个数为:1.2NA,
故答案为:O2+4e-+4H+=2H2O;CH3OH+H2O-6e-═CO2+6H+;1.2NA;
②模拟氯碱工业,若只有铝棒和碳棒两个电极,铝棒作阴极,连接电源的负极,碳棒作阳极,连接电源正极,电解总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:铝棒;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题为综合题,考查钠及其化合物性质、氧化还原反应计算、电化学,熟悉钠、氢化钠性质,明确氧化还原反应规律、原电池工作原理是解题关键,侧重对基础知识的综合应用,题目难度中等.

| A. | AlCl3过量 | |
| B. | AlCl3的量恰好与氢氧化钠完全反应 | |
| C. | 两种碱均过量 | |
| D. | AlCl3的量恰好与氨水完全反应 |
| A. | PCl3 | B. | Cl2 | C. | N2 | D. | HBr |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种 | |
| C. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| D. | 乙酸乙酯中的少量乙酸可用NaOH溶液除去 |
①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
②NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H3
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H4.
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
| A. | 乙醛既具有氧化性也具有还原性 | |
| B. | 煤的气化和干馏原理相同 | |
| C. | 动物油加入稀硫酸生产肥皂 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |