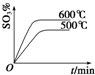
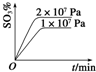
题目内容
3.下列说法正确的是( )| A. | 配制Na2S溶液时,为了抑制S2-的水解,常加入少量氢氧化钠 | |
| B. | 明矾用于净水过程只发生物理变化 | |
| C. | 把纯水加热水的电离程度增大,但水仍然是中性的,pH=7 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
分析 A、S2-是弱酸根,水解显碱性;
B、明矾能净水的原因是其电离出的铝离子水解出氢氧化铝胶体;
C、纯水加热后电离程度增大,溶液中氢离子浓度增大;
D、将氯化铝溶液蒸干后得氢氧化铝.
解答 解:A、S2-是弱酸根,水解显碱性,故为抑制硫离子水解,应加入氢氧化钠,故A正确;
B、明矾能净水的原因是其电离出的铝离子水解出氢氧化铝胶体,具有吸附作用,故能净水,此过程中铝离子的水解为化学变化,故B错误;
C、纯水加热后电离程度增大,溶液中氢离子浓度增大,故溶液的pH小于7,故C错误;
D、将氯化铝溶液蒸干时,水解出的HCl挥发,水解被促进,故得氢氧化铝,得不到氯化铝晶体,故D错误.
故选A.
点评 本题考查了弱电解质的电离平衡和盐类水解平衡的移动,难度不大,应注意的是氯化铝溶液加热蒸干后会水解彻底.

练习册系列答案
相关题目
13.铜 稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液.现将1.92gCu放入足量的稀硫酸中,若要使铜完全溶解,理论上至少应加入NaNO3晶体的物质的量为( )
| A. | 0.02mol | B. | 0.045mol | C. | 0.06mol | D. | 0.08mol |
14.证明某溶液中只含有Fe2+而不含有Fe3+的实验操作是( )
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生红褐色沉淀 | |
| D. | 滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失 |
18.下列说法中,正确的是( )
| A. | 气体摩尔体积Vm=22.4L/mol,则气体所处的状态为标准状况 | |
| B. | 一定条件下,1.4gN2和0.2molH2混合充分反应,转移的电子数目约为1.806×1023个 | |
| C. | 1.0mol/L的Na3PO4溶液中含有的阴离子总数大于6.02×1022个 | |
| D. | 5.0g乙烷中含有的极性键的数目约为6.02×1023个 |
8.有10.3克NaBr样品溶于水后,加入足量AgNO3溶液,最终得到19克沉淀,则NaBr中可能混有的杂质是( )
| A. | KBr | B. | LiBr | C. | NaF | D. | MgBr2 |
3.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | Cl2 | CO2 | CaCl2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl |
| A. | ②③④ | B. | ②③④⑤ | C. | ①③④ | D. | ①③④⑤ |

 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题: