题目内容
18.下列说法中,正确的是( )| A. | 气体摩尔体积Vm=22.4L/mol,则气体所处的状态为标准状况 | |
| B. | 一定条件下,1.4gN2和0.2molH2混合充分反应,转移的电子数目约为1.806×1023个 | |
| C. | 1.0mol/L的Na3PO4溶液中含有的阴离子总数大于6.02×1022个 | |
| D. | 5.0g乙烷中含有的极性键的数目约为6.02×1023个 |
分析 A.标准状况:指0℃、1.01×105Pa的状态.温度越高,体积越大;压强越大,体积越小.故在非标准状况下,其值不一定就是“22.4L”;
B.氮气与氢气的反应是可逆反应,据此判断即可;
C.n=c×V,不知道溶液的体积无法计算其物质的量;
D.1mol乙烷中含有的极性键的物质的量为6,据此计算即可.
解答 解:A.标准状况下气体的摩尔体积为22.4L/mol,但是Vm=22.4L/mol不一定处于标准状况下,故A错误;
B.氮气与氢气化合生成氨气的反应是可逆反应,1.4g氮气不能完全转化为氨气,转移电子数无法计算,故B错误;
C.1.0mol/L的溶液,体积未知,不能计算其物质的量,故C错误;
D.1mol乙烷中含有的极性键的物质的量为6mol,5.0g乙烷含有的极性键为1mol,故D正确,
故选D.
点评 本题考查物质的量、摩尔质量、气体摩尔体积的定义、单位等,题目难度不大,注意相关概念的积累.

练习册系列答案
相关题目
8.下列关于实验安全的说法中正确的是( )
| A. | 实验室可用燃着的酒精灯取点燃另一只酒精灯 | |
| B. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| C. | 化学品仓库保存的金属钠着火时可用水灭 | |
| D. | 盛放浓盐酸的试剂瓶上要贴上如图 的标志 的标志 |
6.有关碰撞理论,下列说法中正确的是( )
| A. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 | |
| C. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
13.豆类中的香豆雌酚是一种植物雌性激素,其结构式如图所示,下列有关说法正确的是( )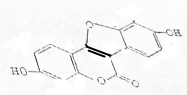

| A. | 该物质的分子式为C15H10O5 | |
| B. | 该物质中所有原子一定在同一平面内 | |
| C. | 1mol该物质最多可与5molBr2发生反应 | |
| D. | 1mol该物质最多可与3molNaOH发生反应 |
3.下列说法正确的是( )
| A. | 配制Na2S溶液时,为了抑制S2-的水解,常加入少量氢氧化钠 | |
| B. | 明矾用于净水过程只发生物理变化 | |
| C. | 把纯水加热水的电离程度增大,但水仍然是中性的,pH=7 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
1.有关反应的离子方程式书写正确的是( )
| A. | a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| C. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
19.如图所示的实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |