题目内容
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,46g NO2与N2O4的混合气体含有原子总数为3NA | |
| B. | 92g甲苯中含有碳碳双键数目为3 NA | |
| C. | 1 L 1 mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| D. | 标准状况下,2.24L Cl2与水反应转移的电子数目为0.1NA |
分析 A、NO2与N2O4的最简式均为NO2;
B、苯环不是单双键交替的结构;
C、CO32-是弱酸根,在溶液中会水解;
D、氯气和水的反应为可逆反应.
解答 解:A、NO2与N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为n=$\frac{46g}{46g/mol}$=1mol,故含3NA个原子,故A正确;
B、苯环不是单双键交替的结构,故甲苯中不含碳碳双键,故B错误;
C、CO32-是弱酸根,在溶液中会水解,故溶液中碳酸根的个数小于NA个,故C错误;
D、氯气和水的反应为可逆反应,故标况下2.24L氯气的物质的量小于0.1mol,则和水反应转移电子数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列说法错误的是( )
| A. | 乙醇分子中含有羟基 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水无法鉴别苯和四氯化碳 |
7.下列有关化学用语表示不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: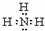 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: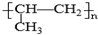 |
17.下列各组中的两组物质互为同系物的是( )
| A. | 乙苯与二甲苯 | B. | 乙醇与乙二醇 | C. | 乙烯与聚乙烯 | D. | 甲烷与新戊烷 |
4.下列说法正确的是( )
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去可证明BaCl2溶液显酸性 | |
| B. | 根据盐溶液的酸碱性,将盐分成酸式盐、正盐和碱式盐 | |
| C. | 泡沫灭火器是利用硫酸铝溶液和碳酸钠溶液反应产生大量CO2和Al(OH)3灭火 | |
| D. | NH4F溶液中含有少量的HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
2.现有20gD2O和36gH2O,下列说法不正确的是( )
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
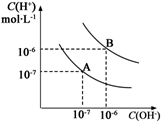 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: