题目内容
17.25℃,两种酸的电离平衡常数如下表.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应生成HSO3-和CO2,据此写出反应的离子方程式.
解答 解:由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱为:H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为:SO2+HCO3-=HSO3-+CO2,
故答案为:SO2+HCO3-=HSO3-+CO2.
点评 本题考查了离子方程式书写,题目难度中等,明确酸性强弱与电离平衡常数的关系为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列有关化学用语表示不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: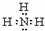 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: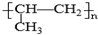 |
8.Na2CO3+CO2+H2O═2NaHCO3的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
5.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 分子数为NA的CO和C2H4混合气体的体积约为22.4 L | |
| B. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH${\;}_{4}^{+}$的数目为0.3NA |
12.下列说法或表述中正确的是( )
| A. | 烷烃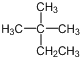 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
2.现有20gD2O和36gH2O,下列说法不正确的是( )
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
6.按要求完成下列实验报告:
实验名称:氯水的性质实验
实验目的:验证氯水:①有酸性,②有漂白性(氧化性),③存在Cl-
实验用品:主要仪器用品:试管、胶头滴管.
选用试剂:新制的饱和氯水、NaOH溶液、滴有酚酞的NaOH溶液,请添加其他必需试剂:品红溶液、硝酸银溶液、稀硝酸.
实验步骤:依次验证氯水的上述三项化学性质.
实验记录表:
实验探究:如果你在步骤①中使用了滴有酚酞的NaOH溶液,如何验证步骤①中氯水是否表现出漂白性?
实验名称:氯水的性质实验
实验目的:验证氯水:①有酸性,②有漂白性(氧化性),③存在Cl-
实验用品:主要仪器用品:试管、胶头滴管.
选用试剂:新制的饱和氯水、NaOH溶液、滴有酚酞的NaOH溶液,请添加其他必需试剂:品红溶液、硝酸银溶液、稀硝酸.
实验步骤:依次验证氯水的上述三项化学性质.
实验记录表:
| 步骤编号 | 操作过程 | 实验现象 | 实验结论 |
| ① | 氯水有酸性 | ||
| ② | 氯水有漂白性 | ||
| ③ | 氯水中存在Cl- |
3.某混合溶液中可能大量含有的离子如下表所示:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示.
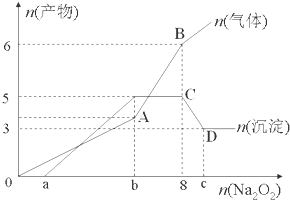
(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)a=1,b=7,c=9.
(3)写出下列离子方程式:
AB段2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
CD段Al(OH)3+OH-=AlO2-+2H2O.
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |

(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)a=1,b=7,c=9.
(3)写出下列离子方程式:
AB段2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
CD段Al(OH)3+OH-=AlO2-+2H2O.
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L 水中含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LN2中含有的原子数为NA | |
| C. | 23g Na与足量H2O反应转移的电子数为NA | |
| D. | 物质的量浓度为1 mol•Lˉ1的K2SO4溶液中,含2 NA个K+ |