题目内容
氮元素可以形成多种化合物.回答以下问题:
(1)氮原子的原子结构示意图是 .
(2)C、N、O三种元素第一电离能从大到小的顺序是 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子轨道的杂化类型是 .
②肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号).a.离子键b.共价键 c.配位键d.范德华力.
(1)氮原子的原子结构示意图是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子轨道的杂化类型是
②肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
考点:原子结构示意图,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:化学用语专题,原子组成与结构专题,化学键与晶体结构
分析:(1)氮原子的核电荷数为7,核外电子数为7;
(2)根据同周期元素的第一电离能,结合2p轨道的稳定状态判断;
(3)①ABm型杂化类型的判断:中心原子电子对计算公式:电子对数n=
(中心原子的价电子数+配位原子的成键电子数±电荷数),当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;
②根据硫酸铵晶体中存在的化学键判断.
(2)根据同周期元素的第一电离能,结合2p轨道的稳定状态判断;
(3)①ABm型杂化类型的判断:中心原子电子对计算公式:电子对数n=
| 1 |
| 2 |
②根据硫酸铵晶体中存在的化学键判断.
解答:
解:(1)氮原子的核电荷数为7,核外电子数为7,原子结构示意图为: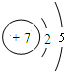 ,
,
故答案为: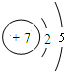 ;
;
(2)同周期元素从左到右元素的第一电离能逐渐增大,由于N的2p轨道为半饱和状态,较稳定,难以失去电子,则C、N、O三种元素第一电离能从大到小的顺序是N>O>C,
故答案为:N>O>C;
(3)①NH3中N原子杂化轨道数为
×(5+3)=4,采取 sp3杂化方式,肼(N2H4)与氨气的杂化方式相同,故N2H4分子中氮原子轨道的杂化类型是sp3;
故答案为:sp3;
②硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4的晶体内存在离子键、共价键和配位键,不含范德华力,
故答案为:d.
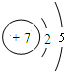 ,
,故答案为:
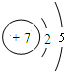 ;
;(2)同周期元素从左到右元素的第一电离能逐渐增大,由于N的2p轨道为半饱和状态,较稳定,难以失去电子,则C、N、O三种元素第一电离能从大到小的顺序是N>O>C,
故答案为:N>O>C;
(3)①NH3中N原子杂化轨道数为
| 1 |
| 2 |
故答案为:sp3;
②硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4的晶体内存在离子键、共价键和配位键,不含范德华力,
故答案为:d.
点评:本题考查原子结构示意图的书写、第一电离能的大小关系、原子的杂化方式、晶体中存在的化学键等知识,知识点较多,难度中等.要注意基础知识的积累.

练习册系列答案
相关题目
下列元素的第一电离能依次减小的是( )
| A、H、Li、Na、K |
| B、I、Br、Cl、F |
| C、Na、Mg、Al、Si |
| D、Si、Al、Mg、Na |
某水溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-中的若干种离子.某同学取100m L的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到 11.65g固体.
下列结论正确的是( )
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到 11.65g固体.
下列结论正确的是( )
| A、实验①中产生的气体为氨气,并可得原溶液中c (NH4+)=0.2 mol?L-1 |
| B、实验③中的白色沉淀中一定有BaSO4,无BaCO3 |
| C、原溶液中一定有K+,且c (K+)=0.5 mol?L-1 |
| D、若要判断原溶液中是否有Cl-,无需另外设计实验验证 |
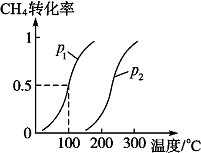 将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.
将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.