题目内容
一定温度下,在2L的密闭容器中加入4molA和6molB,发生如下反应:2A(g)+3B(g)?4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L.下列说法正确的是( )
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,反应10min后达平衡,此时D的浓度为0.5mol/L,物质的量为0.5mol/L×2L=1mol,
2A(g)+3B(g)?4C(g)+D(g)
起始量(mol) 4 6 0 0
变化量(mol) 2 3 4 1
平衡量(mol) 2 3 4 1
A、反应速率v=
计算;
B、10min后向容器中加入A,平衡正向进行,本身转化率减小;
C、反应前后气体体积不变,恒温下将反应容器体积缩小一半,压强增大,平衡不动;
D、浓度c=
计算.
2A(g)+3B(g)?4C(g)+D(g)
起始量(mol) 4 6 0 0
变化量(mol) 2 3 4 1
平衡量(mol) 2 3 4 1
A、反应速率v=
| △c |
| △t |
B、10min后向容器中加入A,平衡正向进行,本身转化率减小;
C、反应前后气体体积不变,恒温下将反应容器体积缩小一半,压强增大,平衡不动;
D、浓度c=
| n |
| V |
解答:
解:依据化学平衡三段式列式计算,反应10min后达平衡,此时D的浓度为0.5mol/L,物质的量为0.5mol/L×2L=1mol,
2A(g)+3B(g)?4C(g)+D(g)
起始量(mol) 4 6 0 0
变化量(mol) 2 3 4 1
平衡量(mol) 2 3 4 1
A、前10min反应的平均速率V(C)=
=0=
=0.20mol/L?min,故A错误;
B、平衡后A转化率=
×100%=50%,10min后向容器中加入A,平衡正向进行,本身转化率减小,重新平衡时A的转化率一定小于50%,故B错误;
C、反应前后气体体积不变,恒温下将反应容器体积缩小一半,压强增大衡不动,D的平衡浓度=
=1.0mol/L,故C错误;
D、反应达平衡时B的平衡浓度c=
=
=1.5mol/L,故D正确;
故选D.
2A(g)+3B(g)?4C(g)+D(g)
起始量(mol) 4 6 0 0
变化量(mol) 2 3 4 1
平衡量(mol) 2 3 4 1
A、前10min反应的平均速率V(C)=
| △c |
| △t |
| ||
| 10min |
B、平衡后A转化率=
| 2mol |
| 4mol |
C、反应前后气体体积不变,恒温下将反应容器体积缩小一半,压强增大衡不动,D的平衡浓度=
| 1mol |
| 1L |
D、反应达平衡时B的平衡浓度c=
| n |
| V |
| 3mol |
| 2L |
故选D.
点评:本题考查了化学平衡的计算应用,主要是反应速率、转化率的计算,主要是一些化学平衡的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列分子中所有的原子最外层达到8电子构型的是( )
| A、BF3 |
| B、SiH4 |
| C、SF6 |
| D、PCl3 |
下列说法不正确的是( )
| A、室温下将CaO、Na2O、Na、NaOH各5克分别投入100克水中,充分搅拌后,所得溶液中溶质的质量分数最小的是CaO |
| B、正戊烷、异戊烷、新戊烷的熔沸点由高到低的顺序为新>异>正 |
| C、AlO2-、HCO3-、Na+、K+等离子不能在水溶液里大量共存 |
| D、将NaHCO3溶液和Na2SO3溶液分别蒸干灼烧,得到的固体都不是原溶质 |
在下面的电子结构中,第一电离能最小的原子可能是( )
| A、ns2np3 |
| B、ns2np5 |
| C、ns1 |
| D、ns2np6 |
工业用洗净的废铜作原料来制备硝酸铜.为了节约原料和防止污染,宜采取的方法是( )
A、Cu
| |||||
B、Cu
| |||||
C、Cu
| |||||
D、Cu
|
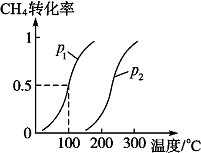 将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.
将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图. 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: