题目内容
10. 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4(或2SO2+O2?2SO3;SO3+H2O=H2SO4或2SO2+O2+2H2O=2H2SO4).
(2)工业上用Na2SO3溶液吸收烟气中的SO2.将烟气通入1.0mol•L-1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂.
①此时溶液中c(SO32-)的浓度是0.2mol•L-1,则溶液中c(HSO3-)是1.6mol•L-1.
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是2NaHSO3+O2═Na2SO4+H2SO4.
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则:降低含硫烟气温度(或流速),有利于提高SO2的吸收效率.
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000g.
步骤ii 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii 移取25.00mL样品溶液于250mL锥形瓶中,用0.01000mol•L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;
②在配制0.01000mol•L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量偏大(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是AC (填字母).

④滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
分析 (1)根据SO2气体是酸性氧化物,可与水反应生成亚硫酸,亚硫酸可被氧化生成硫酸,二氧化硫具有还原性,在空气中经粉尘催化氧化为SO3,SO3与水反应能生成硫酸;
(2)①结合Na2SO3+SO2+H2O═2NaHSO3分析离子浓度;
②向pH约为6的吸收剂中通入足量的O2,发生氧化还原反应生成硫酸钠和硫酸.
(3)根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低;
③根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低;
(3)①Na2SO3与酸性KMnO4溶液反应,亚硫酸根离子被氧化生成硫酸根离子,高锰酸根离子被还原为锰离子,根据守恒原理配平反应的离子方程式;
②在配制0.01000mol•L-1 KMnO4溶液时若仰视定容,KMnO4溶液浓度将偏低,所需KMnO4溶液体积偏大,则最终测得药品中Na2SO3的含量偏大;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
④根据计算出消耗的高锰酸钾的物质的量,再根据反应方程式5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O计算出25mLNa2SO3溶液消耗的亚硫酸根离子的物质的量,再计算出250mL亚硫酸钠溶液中含有亚硫酸钠的物质的量,最后计算出实验室里的Na2SO3的纯度.
解答 解:(1)SO2气体是酸性氧化物,可与水反应生成亚硫酸,亚硫酸可被氧化生成硫酸,二氧化硫具有还原性,在空气中经粉尘催化氧化为SO3,SO3与水反应能生成硫酸,有关反应的化学方程式为:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4 (或2SO2+O2?2SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4),
故答案为:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4 (或2SO2+O2?2SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4);
(2)①由Na2SO3+SO2+H2O═2NaHSO3,c(SO32-)的浓度是0.2mol•L-1,则反应的Na2SO3溶液为1.0mol/L-0.2mol/L=0.8mol/L,由反应中的物质的量关系可知,生成的c(HSO3-)为0.8mol/L×2=1.6mol/L,故答案为:1.6;
②向pH约为6的吸收剂中通入足量的O2,发生氧化还原反应生成硫酸钠和硫酸,发生的反应为2NaHSO3+O2═Na2SO4+H2SO4,
故答案为:2NaHSO3+O2═Na2SO4+H2SO4;
③根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),
故答案为:降低含硫烟气温度(或流速);
(3)①Na2SO3与酸性KMnO4溶液反应,亚硫酸根离子被氧化生成硫酸根离子,高锰酸根离子被还原为锰离子,
配平反应的离子方程式:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,
故答案为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;
②在配制0.01000mol•L-1 KMnO4溶液时若仰视定容,KMnO4溶液浓度将偏低,需KMnO4溶液体积偏大,则最终测得药品中Na2SO3的含量偏大,故答案为:偏大;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:AC;
④根据滴定结果:三次滴定所用标准溶液的体积分别为:21.03-1.02=20.01mL,21.99-2.00=19.99mL,20.20-2.20=18.00,第三次误差太大,需舍去;前两次实验所用标准溶液的体积平均值为20.00mL;25mLNa2SO3溶液中亚硫酸钠消耗的高锰酸钾的物质的量为:0.01mol/L×0.020L=0.0002mol,
根据反应方程式:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O
5 2
n 0.0002mol
n(SO32-)=0.0005mol,
250mL亚硫酸钠溶液中含有亚硫酸钠的物质的量为:0.0005mol×$\frac{250}{25}$=0.005mol,
样品中含有的亚硫酸钠的质量为:m(SO32-)=126g/mol×0.005mol=0.63g,
ω(SO32-)=$\frac{0.63g}{1g}$×100%=63.00%,
故答案为:63.00%.
点评 本题考查元素化合物性质、化学工艺流程、基本操作与方案设计、数据分析与处理、化学方程式和离子方程式的书写等,难度中等,是对所学知识的综合利用,为高考常见题型.

| A. | 亚硫酸钠溶液显碱性:SO32-+2 H2O?H2SO3+2 OH- | |
| B. | 氯化银投入水中后建立平衡:AgCl (s)?Ag+(aq)+Cl-(aq) | |
| C. | 甲烷的燃烧热为890.3kJ•mol-1,表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
| A. | H2(g)+Cl2(g)=2HCl(g);△H=-a $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H=-b | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO (g);△H=-a C(s)+O2(g)=CO2 (g);△H=-b | |
| C. | 2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b | |
| D. | S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b |
 如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )
如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )| A. | 阿斯匹林的化学式为C9H8O4 | |
| B. | 该化合物具有酸性,能与 NaOH 或 NaHCO3反应 | |
| C. | 1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为2 mol | |
| D. | 纯净的 Aspirin 不能与 FeCl3溶液反应,但它的水解产物能使FeCl3溶液显色 |

 b.Na2CO3溶液 c.Na2SO4溶液
b.Na2CO3溶液 c.Na2SO4溶液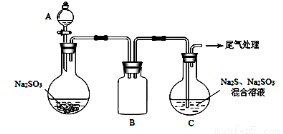

 或
或 .
. (注明反应条件).
(注明反应条件). .
.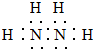 ,其中氮的化合价为-2价.
,其中氮的化合价为-2价.