题目内容
1.对氨基水杨酸钠是一种抑制结核杆菌的药物,合成路线如下: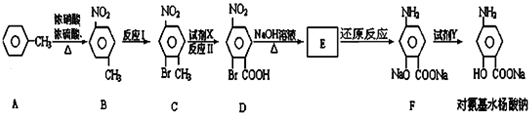
(1)对氨基水杨酸钠化学式为C7H6O3NNa;化合物D中含有的官能团(除苯环外)的名称是硝基、羧基和溴原子.
(2)化合物B的一溴代物除化合物C外,还有2种,写出其中一种的结构简式
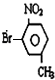 或
或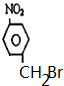 .
.(3)下列说法正确的是ab.
a.反应Ⅰ属于取代反应,反应Ⅱ属于氧化反应
b.对氨基水杨酸钠既能与盐酸反应,也能与氢氧化钠溶液反应
c.化合物A-F均属于芳香烃
d.试剂X可为KMnO4,试剂Y可为过量盐酸
(4)由A生成B的反应方程式为
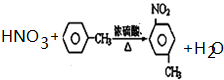 (注明反应条件).
(注明反应条件).(5)化合物E的结构简式为
 .
.
分析 A发生取代反应或硝化反应生成B,B发生取代反应生成C,C发生氧化反应生成D,根据CD结构简式知,C中甲基被酸性高锰酸钾溶液氧化生成羧基,D发生水解反应、中和反应生成E,E发生还原反应生成F,E结构简式为 ,Y为CO2,结合题目分析解答.
,Y为CO2,结合题目分析解答.
解答 解:A发生取代反应或硝化反应生成B,B发生取代反应生成C,C发生氧化反应生成D,根据CD结构简式知,C中甲基被酸性高锰酸钾溶液氧化生成羧基,D发生水解反应、中和反应生成E,E发生还原反应生成F,E结构简式为 ,Y为CO2,
,Y为CO2,
(1)对氨基水杨酸钠化学式为C7H6O3NNa;化合物D中含有的官能团(除苯环外)的名称是硝基、羧基和溴原子,
故答案为:C7H6O3NNa;硝基、羧基和溴原子;
(2)化合物B的一溴代物除化合物C外,还有2种,其结构简式为 或
或 ,
,
故答案为: 或
或 ;
;
(3)a.反应Ⅰ中H原子被溴原子取代,所以属于取代反应,反应Ⅱ中甲基被酸性高锰酸钾溶液氧化,属于氧化反应,故正确;
b.对氨基水杨酸钠中含有氨基和酚羟基,具有碱性和酸性,所以既能与盐酸反应,也能与氢氧化钠溶液反应,故正确;
c.化合物B-F中除了含有C、H元素外还含有其它元素,所以不属于芳香烃,A中只含C、H元素且含有苯环,属于芳香烃,故错误;
d.试剂X可为KMnO4,试剂Y可为过量二氧化碳,故错误;
故选ab;
(4)A和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成硝基苯,由A生成B的反应方程式为 ,
,
故答案为: ;
;
(5)化合物E的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物合成,为高频考点,明确反应前后物质结构变化特点及反应类型是解本题关键,侧重考查学生分析推断能力,涉及物质结构判断、化学方程式的书写、反应类型判断、官能团判断等知识点,题目难度不大.

练习册系列答案
相关题目
9.下列有机物的命名正确的是( )
| A. | 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 2-甲基-3-戊炔 | |
| D. | 邻甲基苯酚 |
16.下列有机物的命名正确的是( )
| A. | CH3CH2CH(CH3)CH(CH3)OH:3-甲基-2-戊醇 | |
| B. | CH3CH(CH3)CH═CH2:3-甲基丁烯 | |
| C. | CH3CH2C(CH3)2CH3:2,2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl:二氯乙烷 |
13.与饱和链烃、不饱和链烃相比较,苯的独特性质具体来说是( )
| A. | 难氧化,易加成,难取代 | |
| B. | 能氧化,难加成,易取代 | |
| C. | 易氧化,易加成,难取代 | |
| D. | 因是单双键交替结构,故易加成为环己烷 |
10. 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4(或2SO2+O2?2SO3;SO3+H2O=H2SO4或2SO2+O2+2H2O=2H2SO4).
(2)工业上用Na2SO3溶液吸收烟气中的SO2.将烟气通入1.0mol•L-1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂.
①此时溶液中c(SO32-)的浓度是0.2mol•L-1,则溶液中c(HSO3-)是1.6mol•L-1.
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是2NaHSO3+O2═Na2SO4+H2SO4.
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则:降低含硫烟气温度(或流速),有利于提高SO2的吸收效率.
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000g.
步骤ii 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii 移取25.00mL样品溶液于250mL锥形瓶中,用0.01000mol•L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;
②在配制0.01000mol•L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量偏大(填“偏大”、“偏小”或“无影响”).
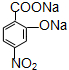
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是AC (填字母).
④滴定结果如下表所示:
则该药品中Na2SO3的质量分数为63.00%.
 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4(或2SO2+O2?2SO3;SO3+H2O=H2SO4或2SO2+O2+2H2O=2H2SO4).
(2)工业上用Na2SO3溶液吸收烟气中的SO2.将烟气通入1.0mol•L-1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂.
①此时溶液中c(SO32-)的浓度是0.2mol•L-1,则溶液中c(HSO3-)是1.6mol•L-1.
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是2NaHSO3+O2═Na2SO4+H2SO4.
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则:降低含硫烟气温度(或流速),有利于提高SO2的吸收效率.
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000g.
步骤ii 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii 移取25.00mL样品溶液于250mL锥形瓶中,用0.01000mol•L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;
②在配制0.01000mol•L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量偏大(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是AC (填字母).

④滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
 、SO
、SO ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
 是_____________________。
是_____________________。
 冶炼铁都需要用到的原料是石灰石
冶炼铁都需要用到的原料是石灰石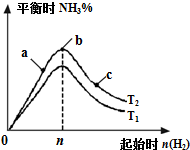 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):