题目内容
10.铜与浓硫酸共热反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+SO2↑.分析 铜与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,据此书写方程式.
解答 解:铜与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,方程式:Cu+2H2SO4(浓) $\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+SO2↑;
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+SO2↑;
点评 本题考查了化学方程式的书写,明确浓硫酸的强氧化性和酸性是解题关键,注意铜与浓硫酸反应条件为加热,题目难度不大.

练习册系列答案
相关题目
18.下列物质能使品红溶液褪色的是( )
| A. | 二氧化硫 | B. | 氧化钠 | C. | 氯水 | D. | 溴水 |
2.20℃时,饱和NaCl溶液的密度为1.12g•cm-3,质量分数是26.5%,则下列说法正确的是( )
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
10.铁是人体必需元素,是合成血红素的重要原料,缺铁会造成贫血,市场上常见补血剂有硫酸亚铁、富马酸亚铁(分子式C4H2O4Fe)、葡萄糖酸亚铁、琥珀酸亚铁(速力菲片)等.某化学兴趣小组通过实验对硫酸亚铁补血剂成分进行探究并测定Fe2+的含量,可供选择的试剂有双氧水、KSCN溶液、盐酸、BaCl2溶液(已知KSCN可被双氧水氧化).
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
(2)配制硫酸亚铁补血剂的待测溶液.
补血剂(1片0.5克)$\stackrel{①溶解}{→}$浊液$→_{③}^{②脱色}$滤液$\stackrel{④氧化}{→}$配成1L待测液
①步骤③浊液脱色后进行A(填标号)操作才能得到溶液.

②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是因为硫酸亚铁在加热过程中易被氧化,,你的方案是加入足量铁粉,小心蒸发至出现结晶膜时停止加热.
③已知步骤④中加入足量的H2O2溶液,作用是将Fe2+完全氧化成Fe3+,然后微热并用玻璃棒搅拌至无气泡产生,目的是除去过量的H2O2.
④写出步骤④中发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)测定硫酸亚铁补血剂待测液的浓度
【方法一】用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图.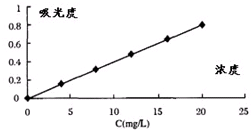
⑤取待测液10mL滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是12%.
【方法二】KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2mol•L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL.
⑥KMnO4溶液置于酸式滴定管中,终点的颜色变化:浅绿色变成浅黄色
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是维生素C具有还原性,防止Fe2+被氧化.
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |
补血剂(1片0.5克)$\stackrel{①溶解}{→}$浊液$→_{③}^{②脱色}$滤液$\stackrel{④氧化}{→}$配成1L待测液
①步骤③浊液脱色后进行A(填标号)操作才能得到溶液.

②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是因为硫酸亚铁在加热过程中易被氧化,,你的方案是加入足量铁粉,小心蒸发至出现结晶膜时停止加热.
③已知步骤④中加入足量的H2O2溶液,作用是将Fe2+完全氧化成Fe3+,然后微热并用玻璃棒搅拌至无气泡产生,目的是除去过量的H2O2.
④写出步骤④中发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)测定硫酸亚铁补血剂待测液的浓度
【方法一】用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图.

⑤取待测液10mL滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是12%.
【方法二】KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2mol•L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL.
⑥KMnO4溶液置于酸式滴定管中,终点的颜色变化:浅绿色变成浅黄色
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是维生素C具有还原性,防止Fe2+被氧化.
 为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置
为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置