题目内容
已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式,据此计算.
解答:
解:①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1,
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1,
由盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=+140kJ/mol+(-221kJ/mol)=-81kJ?mol-1;
故选D.
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1,
由盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=+140kJ/mol+(-221kJ/mol)=-81kJ?mol-1;
故选D.
点评:本题考查盖斯定律、反应热的计算,比较基础,理解盖斯定律,利用已知热化学方程式进行叠加构造目标热化学方程式是关键.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列关于元素电负性大小的比较中,不正确的是( )
| A、Se<Te<S<O |
| B、C<N<O<F |
| C、P<S<O<F |
| D、K<Na<Mg<Al |
下列实验方案可行的是( )
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
下列有关实验的说法正确的是( )
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
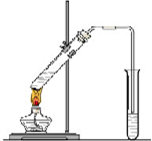 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题